
| A、C2H4 |
| B、C3H6 |
| C、C2H6 |
| D、C5H12 |
| 点燃 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
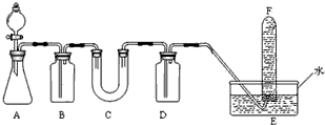
| 仪器 | 加入试剂 | 加入试剂的目的 |
| B | 饱和NaHCO3溶液 | |
| C | ||
| D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
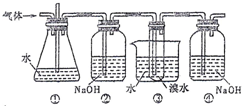 如图是用实验室制得的乙烯(C2H5OH
如图是用实验室制得的乙烯(C2H5OH | 浓硫酸 |
| 170℃ |
| A、装置①和装置③中都盛有水,其作用相同 |
| B、装置②和装置④中都盛有NaOH溶液,其吸收的杂质相同 |
| C、产物可用分液的方法进行分离,1,2-二溴乙烷应从分液漏斗的上口倒出 |
| D、制备乙烯和生成1,2-二溴乙烷的反应类型分别是消去反应和加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
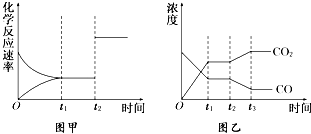 已知化学反应①:Fe(s)+CO2(g)?FeO(s)+CO(g),其平衡常数为K1;
已知化学反应①:Fe(s)+CO2(g)?FeO(s)+CO(g),其平衡常数为K1;| 温度 | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
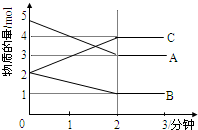 某可逆反应从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示.则该反应的反应物是
某可逆反应从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示.则该反应的反应物是查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com