分析:(1)反应①中,升高温度,化学平衡常数增大,说明平衡向正反应方向移动,升高温度平衡向吸热反应方向移动;
(2)将方程式①-②得反应③:CO
2(g)+H
2(g)?CO(g)+H
2O(g),K
3=
=
.=
;
升高温度根据平衡常数变化确定反应热;
(3)该反应是反应前后气体体积不变的吸热反应,平衡向正反应方向移动同时υ
正增大,可以采用升高温度的方法;
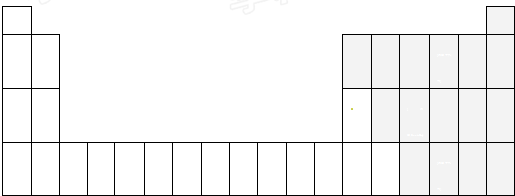
(4)①图甲中t
2时刻,正逆反应速率同等程度的增大,平衡不移动,可以采用使用催化剂、增大压强的方法;
②图乙中t
2时刻,二氧化碳浓度增大、CO浓度减小,平衡向逆反应方向移动;
(5)在830℃温度下,反应③的K值为1,开始时c(CO
2)=
=0.5mol/L、c(H
2)=
=1.5mol/L,
设平衡时参加反应的氢气浓度为xmol/L,
CO
2(g)+H
2(g)?CO(g)+H
2O(g)
开始0.5mol/L 1.5mol/L 0 0
反应xmol/L xmol/L xmol/L xmol/L
平衡(0.5-x)mol/L(1.5-x)mol/L xmol/L xmol/L
化学平衡常数K=
=1,x=0.375,
据此计算平衡时CO浓度、氢气的转化率;
温度不变,化学平衡常数不变,据此进行计算.
解答:
解:(1)反应①中,升高温度,化学平衡常数增大,说明平衡向正反应方向移动,升高温度平衡向吸热反应方向移动,所以正反应是吸热反应,故答案为:吸热;
(2)将方程式①-②得反应③:CO
2(g)+H
2(g)?CO(g)+H
2O(g),K
3=
=
.=
,升高温度,K
1增大、K
2减小,则K
3增大,则该反应是吸热反应,故答案为:
;K
3=
;吸热;
(3)该反应是反应前后气体体积不变的吸热反应,平衡向正反应方向移动同时υ
正增大,可以采用升高温度的方法,故选C;
(4)①该反应是反应前后气体体积不变的吸热反应,图甲中t
2时刻,正逆反应速率同等程度的增大,平衡不移动,可以采用使用催化剂、增大压强的方法,
故答案为:增大压强或使用催化剂;
②该反应是反应前后气体体积不变的吸热反应,图乙中t
2时刻,二氧化碳浓度增大、CO浓度减小,平衡向逆反应方向移动,可以采用降低温度、分离出氢气的方法,
故答案为:降低温度或从体系中分离出H
2;
(5)在830℃温度下,反应③的K值为1,开始时c(CO
2)=
=0.5mol/L、c(H
2)=
=1.5mol/L,
设平衡时参加反应的氢气浓度为xmol/L,
CO
2(g)+H
2(g)?CO(g)+H
2O(g)
开始 0.5mol/L 1.5mol/L 0 0
反应 xmol/L xmol/L xmol/L xmol/L
平衡(0.5-x)mol/L(1.5-x)mol/L xmol/L xmol/L
化学平衡常数K=
=1,x=0.375,
则平衡时CO浓度=(0.5-0.375)mol/L=0.125mol/L,氢气的转化率=
×100%=25%;
温度不变,化学平衡常数不变,
设平衡时参加反应的CO浓度为ymol/L,开始时c(CO
2)=
=1mol/L、c(H
2)=
=3mol/L,
CO
2(g)+H
2(g)?CO(g)+H
2O(g)
开始1mol/L 3mol/L 0 0
反应ymol/L ymol/L ymol/L ymol/L
平衡(1-y)mol/L(3-y)mol/L ymol/L ymol/L
化学平衡常数K=
=1,y=0.75,
平衡时c(CO)=0.75mol/L,
二氧化碳体积分数等其物质的量分数=
×100%=6.25%,
故答案为:0.375;25%; 0.75;6.25%.

 已知化学反应①:Fe(s)+CO2(g)?FeO(s)+CO(g),其平衡常数为K1;
已知化学反应①:Fe(s)+CO2(g)?FeO(s)+CO(g),其平衡常数为K1;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案