
【题目】下列关于各图的说法,正确的是 ( )

A.①中阴极处能产生使湿润淀粉KI试纸变蓝的气体
B.②中待镀铁制品应与电源正极相连
C.③中钢闸门应与外接电源的正极相连
D.④中的离子交换膜可以避免生成的Cl2与NaOH溶液反应
 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:
【题目】分子的性质是由分子的结构决定的,通过对下列分子结构的观察来推测它的性质:
![]()
(1)苯基部分可发生____反应和____反应。
(2)—CH![]() CH2部分可发生____反应和___反应。
CH2部分可发生____反应和___反应。
(3)写出此有机物形成的高分子化合物的结构简式:_______。
(4)试判断此有机物的—C(CH2Cl)3部分_______(填“能”或“不能”)发生消去反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式不正确的是
A. 实验室制乙炔:CaC2+2H2O→Ca(OH)2+C2H2↑
B. 丁二烯的1,4-加成:H2C=CHCH=CH2+Cl2→CH2ClCH=CHCH2Cl
C. 向苯酚钠溶液中加入少量CO2:

D. 乙醛与新制氢氧化铜反应:CH3CHO+2Cu(OH)2+NaOH![]() CH3COONa+Cu2O↓+3H2O
CH3COONa+Cu2O↓+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2015山东卷】毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:

(1)毒重石用盐酸浸取前需充分研磨,目的是 。实验室用37%的盐酸配置15%的盐酸,除量筒外还需使用下列仪器中的 。
a.烧杯 b.容量瓶 c.玻璃棒 d.滴定管
(2)
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
加入NH3·H2O调节pH=8可除去 (填离子符号),滤渣Ⅱ中含 (填化学式)。加入H2C2O4时应避免过量,原因是 。
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
(3)利用简洁酸碱滴定法可测定Ba2+的含量,实验分两步进行。
已知:2CrO42—+2H+=Cr2O72—+H20 Ba2++CrO42—=BaCrO4↓
步骤Ⅰ 移取xml一定浓度的Na2CrO4溶液与锥形瓶中,加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0mL。
步骤Ⅱ:移取y mLBaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ 相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL。
滴加盐酸标准液时应用酸式滴定管,“0”刻度位于滴定管的 (填“上方”或“下方”)。BaCl2溶液的浓度为 mol·L-1,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将 (填“偏大”或“偏小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列高分子化合物回答问题:
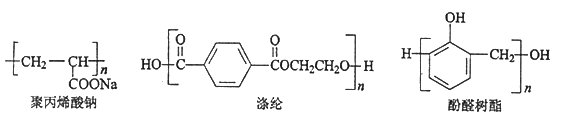
(1)合成聚丙烯酸钠的单体的结构简式是__________,反应类型是__________;
(2)合成涤纶有两种单体,其中能和NaHCO3反应的单体的结构简式是__________,其核磁共振氢谱的峰面积比是_________;
(3)①合成酚醛树脂需要两种单体,和这两种单体均可以发生反应的试剂是__________(填字母序号);
a. H2 b. Na c. Na2CO3 d. 溴水
② 和乙醛在酸性条件下也可以发生类似于制备酚醛树脂的反应,此反应的化学方程式是____________________。
和乙醛在酸性条件下也可以发生类似于制备酚醛树脂的反应,此反应的化学方程式是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向25 mL 0.1 mol·L-1弱碱MOH溶液中逐滴滴加0.2 mol·L-1的HCl,溶液pH的变化曲线如图所示(溶液混合时体积的变化忽略不计)。下列说法正确的是( )
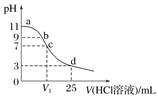
A. MOH电离方程式为MOH===M++OH-
B. 在b点,离子浓度大小为c(OH-)>c(H+)>c(M+)>c(Cl-)
C. 在c点,滴加的V(HCl)>12.5 mL
D. 在d点,c(Cl-)=2c(MOH)+2c(M+)=0.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2015四川卷】(NH4)2SO4是常见的化肥和化工原料,受热易分解。某兴趣小组拟探究其分解产物。
[查阅资料] (NH4)2SO4在260℃和400℃时分解产物不同。
[实验探究]该小组拟选用下图所示装置进行实验(夹持和加热装置略)
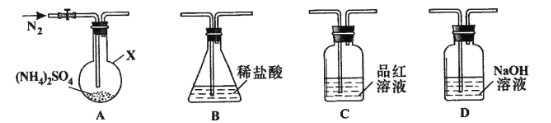
实验1:连接装置A-B-C-D,检查气密性,按图示加入试剂(装置B盛0.5000mol/L盐酸70.00mL)。通入N2排尽空气后,于260℃加热装置A一段时间,停止加热,冷却,停止通入N2。品红溶液不褪色,取下装置B,加入指示剂,用0.2000mol/L NaOH溶液滴定剩余盐酸,终点时消耗NaOH溶液25.00 mL。经检验滴定后的溶液中无SO42-。
(1)仪器X的名称是________________。
(2)滴定前,下列操作的正确顺序是_________(填字母编号)。
a.盛装0.2000mol/L NaOH溶液 b.用0.2000mol/L NaOH溶液润洗
c.读数、记录 d.查漏、清洗 e.排尽滴定管尖嘴的气泡并调整液面
(3)装置B内溶液吸收气体的物质的量是__________mol
实验2:连接装置A-D-B,检查气密性,按图示重新加入试剂。通入N2排尽空气后,于400℃加热装置A至(NH4)2SO4完全分解无残留物,停止加热,冷却,停止通入N2。观察到装置A、D之间的导气管内有少量白色固体。经检验,该白色固体和装置D内溶液中有SO32-,无SO42-。进一步研究发现,气体产物中无氮氧化物。
(4)检验装置D内溶液中有SO32-,无SO42-的实验操作和现象是__________.
(5)装置B内溶液吸收的气体是____________.
(6)(NH4)2SO4在400℃分解的化学方程式是______________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用元素周期律解释的是
A. 酸性:HClO4 > H2SO3 B. 碱性:NaOH > Mg(OH)2
C. 气态氢化物的稳定性:H2O > H2S D. Cl2从NaBr溶液中置换出Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不正确的是
A | B | C | D |
|
|
|
|
钢铁表面水膜的酸性很弱或呈中性,发生吸氧腐蚀 | 钢铁表面水膜的酸性较强,发生析氢腐蚀 | 将锌板换成铜板对钢闸门保护效果更好 | 钢闸门作为阴极而受到保护 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com