
【题目】下列反应中符合离子反应 H++OH-=H2O 的是
A. 稀硫酸与稀氨水 B. 稀硫酸与氢氧化钡溶液
C. 浓硝酸与氢氧化钡溶液 D. 盐酸与氢氧化铁胶体反应
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在固定容积的密闭容器中进行如下反应:2SO2(g)+O2(g) ![]() 2SO3(g),已知反应过程某一时刻SO2、O2、SO3浓度分别为0.2 mol/L、0.1 mol/L、0.2 mol/L,达到平衡时浓度可能正确的是
2SO3(g),已知反应过程某一时刻SO2、O2、SO3浓度分别为0.2 mol/L、0.1 mol/L、0.2 mol/L,达到平衡时浓度可能正确的是
A. SO2、O2分别为0.4 mol/L、0.2 mol/L B. SO2为0.25 mol/L
C. SO2、SO3均为0.15 mol/L D. SO2为0.24 mol/L,SO3为0.14 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚铁盐、铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用,现用铁屑与硫酸反应制备硫酸亚铁。
已知:①4Fe2++O2+4H+===4Fe3++2H2O
②硫酸亚铁在水中的溶解度如下图:
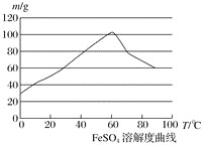
(1)首先,将铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑。此步骤中,分离出液体的方法通常不用过滤,使用的操作是____________(填写操作名称)。
(2)向处理过的铁屑中加入适量的硫酸,在一定温度下使其反应到不再产生气体,趁热过滤,得硫酸亚铁溶液。
①硫酸浓度应选择(填字母序号)__________;
A.浓硫酸 B.10 moL·L-1硫酸
C.3 moL·L-1硫酸 D.任意浓度硫酸
②温度宜控制在________,加热的同时需适当补充水,原因是___________________;
③反应中应保持![]() _________ (填“<”“>”或“=”) 1。
_________ (填“<”“>”或“=”) 1。
(3)亚铁盐在空气中易被氧化,但形成复盐可稳定存在,如“摩尔盐”,即(NH4)2SO4·FeSO4·6H2O(硫酸亚铁铵),就是在硫酸亚铁溶液中加入少量稀硫酸溶液,再加入饱和硫酸铵溶液,经过_______、_______、_______、_______等一系列操作后所得。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知CH4(g)+2O2(g)===CO2(g)+2H2O(l)ΔH=-Q1 kJ·mol-1
H2(g)+![]() O2(g)===H2O(g)ΔH=-
O2(g)===H2O(g)ΔH=-![]() Q2 kJ·mol-1
Q2 kJ·mol-1
H2(g)+![]() O2(g)===H2O(l)ΔH=-
O2(g)===H2O(l)ΔH=-![]() Q3 kJ·mol-1
Q3 kJ·mol-1
常温下取体积比为4∶1的甲烷和氢气的混合气体11.2 L(标准状况),经完全燃烧后恢复到室温,则放出的热量(单位:kJ)为
A. 0.4Q1+0.05Q3B. 0.4Q1+0.05Q2C. 0.4Q1+0.1Q3D. 0.4Q1+0.2Q2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,向10mL浓度均为0.1mol·L-1的NaOH和Na2CO3混合溶液中滴0.1mol·L-1的盐酸,溶液pH随盐酸加入体积的变化如图所示。下列说法正确的是

A. 在a点的溶液中,c(Na+)>c(CO32-)>c(Cl-)>c(OH-)>c(H+)
B. 在b点的溶液中,2n(CO32-)+n(HCO3-)<0.001mol
C. 在c点的溶液pH<7,是因为此时HCO3-的电离能力大于其水解能力
D. 若将0.1mol·L-1的盐酸换成同浓度的醋酸,当滴至溶液的pH=7时:c(Na+)=c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液 pH,金属阳离子浓度的变化如图所示.据图分析,则下列判断错误的是

A. Ksp〔Fe(OH)3〕<Ksp〔Cu(OH)2〕
B. 加适量浓NH3·H2O可使溶液由a 点变到b点
C. c、d两点代表的溶液中c(H+) 与c(OH-)乘积不相等
D. Fe(OH)3在d点代表的溶液过饱和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某充电宝锂离子电池的总反应为:xLi + Li1-xMn2O4![]() LiMn2O4,某手机镍氢电池总反应为:NiOOH + MH
LiMn2O4,某手机镍氢电池总反应为:NiOOH + MH![]() M+ Ni(OH)2(M为储氢金属或合金),有关上述两种电池的说法不正确的是:
M+ Ni(OH)2(M为储氢金属或合金),有关上述两种电池的说法不正确的是:

A. 锂离子电池放电时Li+向正极迁移
B. 镍氢电池放电时,正极电极反应式:NiOOH+H2O +e-==Ni(OH)2+OH-
C. 上图表示用锂离子电池给镍氢电池充电
D. 锂离子电池充电时,阴极的电极反应式: LiMn2O4—xe-== Li1-xMn2O4+ xLi+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化材料具有高硬度、高强度、高韧性、极高的耐磨性及耐化学腐蚀性等优良的物化性能。以锆英石(主要成分为 ZrSiO4,含有少量Al2O3、SiO2、Fe2O3等杂质)为原料通过碱熔法制备氧化锆(ZrO2)的流程如下:
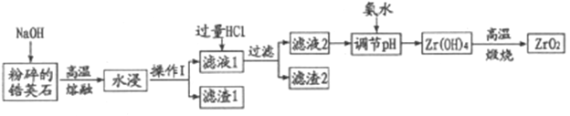
25℃时,有关离子在水溶液中沉淀时的pH数据:
Fe(OH)3 | Zr(OH)4 | Al(OH)3 | |
开始沉淀时pH | 1.9 | 2.2 | 3.4 |
沉淀完全时pH | 3.2 | 3.2 | 4.7 |
请回答下列问题:
(1)流程中旨在提高化学反应速率的措施有___________。
(2)操作I的名称是___________滤渣2的成分为___________。
(3)锆英石经“高温熔融”转化为Na2ZrO3,写出该反应的化学方程式:___________。
(4)“调节pH”时,合适的pH范围是___________。为了得到纯的ZrO2,Zr(OH)4需要洗涤,检验Zr(OH)4是否洗涤干净的方法是___________。
(5)写出“高温煅烧”过程的化学方程式___________。根据ZrO2的性质,推测其两种用途___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com