
【题目】中华人民共和国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25g·L-1。某兴趣小组用题图1装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。
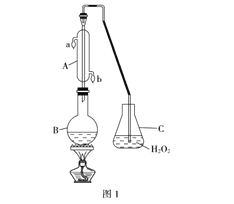
(1)B中加入300.00mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为_______________________________________________________。
(2)除去C中过量的H2O2,然后用0.0900mol·L-1NaOH标准溶液进行滴定。若滴定前俯视,滴定后仰视,对滴定结果的影响是____________(填无影响、偏高或偏低);若滴定前滴定管尖嘴有气泡,滴定后气泡消失,对滴定结果的影响是____________(填无影响、偏高或偏低);若滴定终点时溶液的pH=8.8,则选择的指示剂为___________________;滴定终点的判断为_____________________________________________。
(3)滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2含量为:__________g·L-1。
(4)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施______________________________________。
【答案】SO2+H2O2=H2SO4偏高偏高酚酞滴最后一滴,溶液恰好由无色变浅红色,且30秒无变化0.24原因:盐酸易挥发;改进措施:用不挥发的强酸(如硫酸)代替盐酸,或用蒸馏水代替葡萄酒进行对比实验,排除盐酸挥发的影响。
【解析】
(1)SO2具有还原性,H2O2具有强氧化性,H2O2把SO2氧化成H2SO4,反应方程式为H2O2+SO2=H2SO4;(2)滴定管的从上到下刻度增大,滴定前俯视,滴定后仰视,消耗的NaOH体积增大,测的SO2的量偏高;滴定前滴定管尖嘴有气泡,滴定后气泡消失,消耗的NaOH的体积增大,测的SO2量偏高;选择指示剂,滴定后溶液的pH与指示剂的变色范围应一致,pH=8.8溶液显碱性,酚酞的变色范围是8.2~10.0,因此应用酚酞作指示剂;滴最后一滴NaOH,溶液恰好由无色变浅红色,且30秒无变化;(3)根据过程,得出SO2~H2SO4~2NaOH,n(SO2)=25×10-3×0.09/2mol=1.125×10-3mol,其质量为1.125×10-3×64g=7.2×10-2g,则SO2的含量为7.2×10-2/300×10-3g·L-1=0.24g·L-1;(4)测定结果比实际值偏高,说明溶液中酸的量高,B装置中加入葡萄酒和盐酸,盐酸具有挥发性,加热时,进入装置C,消耗的NaOH的量增加;改进措施为用不挥发的强酸(如硫酸)代替盐酸,或用蒸馏水代替葡萄酒进行对比实验,排除盐酸挥发的影响。


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中放入3L气体R和5L气体Q,在一定条件下发生反应:2R(g)+5Q(g)4X(g)+nY(g)。反应完全后,容器温度不变,混合气体的压强是原来的87.5%,则化学方程式中的n值是( )
A.2B.3C.4D.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的离子,能在溶液中大量共存的是
A. Cu2+、K+、NO3-、SO42- B. H+、Na+、Cl-、OH-
C. Mg2+、SO42-、Ba2+、NO3- D. Na+、H+、NO3-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明代《天工开物》中记载:“属草木者为枲、麻、苘、葛,属禽兽与昆虫者裘褐、丝绵。”文中的“枲、麻、苘、葛”和“裘褐、丝绵”分别属于
A.纤维素、油脂B.糖类、油脂C.纤维素、蛋白质D.油脂、蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列的字母分别代表某一元素。
B | C | D | |||||
A | E | F | |||||
(1)A的的最高价氧化物对应水化物的电子式为__________。
(2)R是由表中已标出的A~F 中某三种元素组成的化合物,是常见家用消毒剂的主要成分,其化学名称为_____________;Na2FeO4是工业常用的消毒剂,利用R 制备Na2FeO4的原理如下,请补齐缺少的物质,并配平反应方程式的系数:___ Fe(OH)3 + ___R(________) + ___ NaOH = ____ Na2FeO4 + ___ NaCl + ____H2O
(3)气态氢化物沸点:D _____ E;元素形成的简单离子的半径:A _____ D(填“>”,“<”或“=”)
(4)E 的某种氧化物通入F 单质的水溶液中,并不能增大F 单质水溶液的漂白性,请结合方程式说明______________________________________________________________。
(5)由表中未标出的某种金属元素的单质G ,可以发生如图所示的转化:
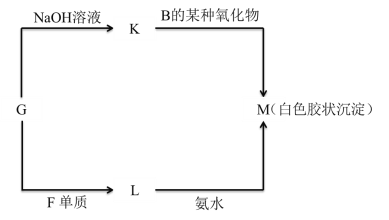
①写出 G 转化为 K 的化学方程式________________________________________。
②写出 L 转化为 M 的离子方程式________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,某反应达到平衡,平衡常数K=c(CO)·c(H2O)/ c(CO2)·c(H2)。恒容时,温度升高,H2浓度减小。下列说法正确的是
A. 该反应的焓变为负值 B. 恒温恒容下,增大压强,H2浓度一定减小
C. 升高温度,逆反应速率减小 D. 该反应的化学方程式为CO2+H2 ![]() CO+H2O
CO+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的叙述正确的是

A. 反应①为取代反应,有机产物的密度比水小
B. 反应②为氧化反应,反应现象是火焰明亮并带有较多的黑烟
C. 反应③为取代反应,反应时可以直接用酒精灯加热,有机产物是一种烃
D. 反应④1molC6H6能与3molH2发生加成反应,是因为苯分子含有三个碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应过程中的能量变化与右图一致的是

A. 2Al+Fe2O3![]() 2Fe+Al2O3
2Fe+Al2O3
B. C+CO2![]() 2CO
2CO
C. CaCO3![]() CaO+CO2↑
CaO+CO2↑
D. C+H2O![]() CO+H2
CO+H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增多。其中A、B、C都是能层数为2的非金属元素。化合物DC为离子化合物,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。E的核外电子排布中有6个未成对电子,是同周期中最多的,ECl3能与B、C的氢化物形成六配体的配合物,且两种配体的物质的量之比为2:1,三个氯离子位于外界。试用相应的元素符号或式子填空:
(1)写出元素的名称 A ___________ E ____________;
(2)A、B、C的第一电离能由小到大的顺序为 __________;B的氢化物分子的空间构型为 _________ 。
(3)化合物AC2与一种由B、C组成的化合物X互为等电子体,则X的化学式为 ____________;完全由B的原子组成的某粒子与AC2也属于等电子体,该粒子的化学式为 _____ ,其空间构型为 __________ 。
(4)ECl3形成的配合物的化学式为 ____________________________ ;
(5)D的单质在AC2中可以燃烧并一种白色固体和一种黑色固体,该反应的化学方程式为 ________ 。
(6)与E同周期,且最外层电子排布相同的元素有___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com