
分析 (1)硫酸与氢氧化钡溶液反应生成硫酸钡沉淀和水;
(2)碳酸钙与盐酸反应生成氯化钙、二氧化碳气体和水;
(3)氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水.
解答 解:(1)H2SO4溶液与Ba(OH)2溶液反应生成硫酸钡沉淀和水,反应的离子方程式为:Ba2++2OH-+2H++SO42-═2BaSO4↓+H2O,
故答案为:Ba2++2OH-+2H++SO42-═2BaSO4↓+H2O;
(2)碳酸钙放入稀盐酸,反应生成氯化钙、二氧化碳和水,反应的离子方程式为:CaCO3+2H+═Ca2++H2O+CO2↑,
故答案为:CaCO3+2H+═Ca2++H2O+CO2↑;
(3)氧化铝放入氢氧化钠溶液中,反应生成偏铝酸钠和水,反应的化学方程式为:Al2O3+2NaOH═2NaAlO2+H2O,
故答案为:Al2O3+2NaOH═2NaAlO2+H2O.
点评 本题考查了离子方程式的书写,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,如难溶物、弱电解质等需要保留化学式,必须符合守恒关系(如:质量守恒和电荷守恒等)等.


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案科目:高中化学 来源: 题型:选择题
| A. | Na+、SO42-、Cl-、NO3- | B. | Na+、HCO3-、Ca2+、Cl- | ||
| C. | Na+、Cl-、NO3-、Fe3+ | D. | K+、Cl、CO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
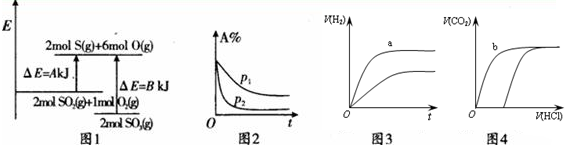
| A. | 图1表示化学反应2S02(g)+O2(g)?2S03(g)的能量变化,该反应的△H=A一BkJ/mol | |
| B. | 图2表示其他条件不变时,反应2A(g)+B(g)?c(g)+D(g)在不同压强下随时间的变化 | |
| C. | 图3表示体积和浓度均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示CH3COOH溶液 | |
| D. | 图4表示100 ml O.1 mol•L-Na2C03和NaHC03两种溶液中,分别逐滴滴加0.1 mol•L-1HCl,产生CO2 的体积随盐酸体积的变化,则b表示NaHCO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100 mL 0.8 mol•L-1MgCl2溶液 | B. | 50 mL 0.5 mol•L-1AlCl3溶液 | ||
| C. | 200 mL 1 mol•L-1NaCl溶液 | D. | 200 mL 2 mol•L-1KClO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在0.1 mol•L-1BA溶液中c(A-)+c(H+)=c(BOH)+c(OH-) | |
| B. | 若将0.1 mol•L-1BOH溶液稀释至0.001 mol•L-1则溶液的pH=9 | |
| C. | 若将一定量的上述两溶液混合后pH=7,则混合液中:c(A-)>c(B+) | |
| D. | 若将上述两溶液按体积比1:2混合,则混合液中:c(B+)>c(A-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲可表示乙酸溶液中通入氨气至过量过程中溶液导电性(I)的变化 | |
| B. | 乙可表示在恒容密闭容器中反应“2SO2(g)+O2(g)?2SO3(g)△H<0”的平衡常数K正、K逆随温度的变化 | |
| C. | 丙表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A | |
| D. | 丁表示常温下,稀释pH相同的HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则HA的酸性比HB的酸性强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com