
【题目】在一定条件下,反应N2+3H22NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为( )
A.v(H2)=0.03mol/(L·min)
B.v(N2)=0.02mol/(L·min)
C.v(NH3)=0.17mol/(L·min )
D.v(NH3)=0.01mol/(L·min)
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g),有关化学键的键能数据如表所示:
Si(s)+4HCl(g),有关化学键的键能数据如表所示:
化学键 | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
键能kJ/mol | 360 | 436 | 431 | 176 | 347 |
下列说法正确的是( )
A.反应中的能量变化与物质的状态无关
B.像这样需要加热才能进行的反应都是吸热反应
C.晶体硅比SiC更稳定
D.该反应中每生成1molSi(s)吸收的能量为236kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求答题:
(l)食品和药物安全是国家高度重视的民生问题。根据题意,用下列选项的字母代号填空。
A.阿司匹林(乙酸水杨酸) B.青霉素 C.抗酸药(氢氧化铝) D.麻黄碱
①治疗胃酸过多,但患有严重的胃溃疡,应该选择_______;
②是一种重要的抗生素类药,有阻止多种细菌生长的功能,该药物是_______;
③能使发热的病人体温降至正常,并起到缓解疼痛的作用,该药物是_______。
(2)钢铁是目前用量最大、用途最广的合金材料,在潮湿空气中容易发生腐蚀。请写出钢铁发生电化学腐蚀的负极反应式_______________________________________。
(3)材料是人类赖以生存的重要物质基础,而化学是材料科学发展的基础。材料种类很多,通常可分为金属材料、无机非金属材料、高分子合成材料及复合材料, 生活中的玻璃、陶瓷、水泥属于上述材料中的______________,
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡: CH3COOH ![]() CH3COO-+H+,对于该平衡,下列叙述正确的是( )
CH3COO-+H+,对于该平衡,下列叙述正确的是( )
A. 加入水时,平衡向逆反应方向移动
B. 加入少量NaOH固体,平衡向正反应方向移动
C. 加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)减小
D. 加入少量CH3COONa固体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
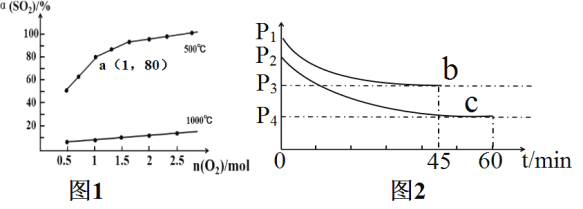
【题目】催化氧化反应:2SO2(g)+O2(g)![]() 2SO3(g) △H<0。在体积可变的密闭容器中,维持压强为1.01×105Pa,充入2molSO2和一定量的O2,SO2的平衡转化率α(SO2)随O2物质的量n(O2)的变化关系如图1所示:
2SO3(g) △H<0。在体积可变的密闭容器中,维持压强为1.01×105Pa,充入2molSO2和一定量的O2,SO2的平衡转化率α(SO2)随O2物质的量n(O2)的变化关系如图1所示:
已知反应aA(g)+bB(g)![]() gG(g)+hH(g)的标准平衡常数Kθ=
gG(g)+hH(g)的标准平衡常数Kθ= ,其中Pθ=1.01×105Pa,PG,PH,PA,PB分别表示G,H,A,B的分压,P(分压)=P(总压)×物质的量分数。
,其中Pθ=1.01×105Pa,PG,PH,PA,PB分别表示G,H,A,B的分压,P(分压)=P(总压)×物质的量分数。
(1)在绝热恒容的密闭容器中,能表明反应2SO2(g)+O2(g)![]() 2SO3(g)已达到平衡状态的是___。
2SO3(g)已达到平衡状态的是___。
A.v(SO2)=2v(O2)
B.当容器内温度不再变化时
C.各组分的物质的量相等
D.容器内气体密度不变
E.混合气体的平均相对分子质量不变
(2)在1000℃时随着O2物质的量的增大,但SO2平衡转化率升高缓慢,其原因是___。
(3)求图1中a点的标准平衡常数Kθ=___。在a点达到平衡后,若保持温度、压强不变,再向体系中充入SO2(g),O2(g),SO3(g)各0.2mol时,此时v(正)___v(逆)(填“<”“>”或“=”)。
(4)若在相同的恒容密闭容器中充入O2和SO2各2mol,在不同温度下达到平衡,反应体系总压强随时间变化如图2所示,则达到平衡状态b和c时,SO3体积分数较大的是___(填“b”或“c”),原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐是优良的多功能水处理剂。某实验小组釆用如图装置制备高铁酸钾![]() 并探究其性质用途。
并探究其性质用途。
资料:![]() 为紫色固体,微溶于KOH溶液,难溶于有机溶剂;具有强氧化性在酸性或中性溶液中紫色快速褪去并产生
为紫色固体,微溶于KOH溶液,难溶于有机溶剂;具有强氧化性在酸性或中性溶液中紫色快速褪去并产生![]() ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。
Ⅰ![]() 制备
制备![]() 夹持、加热等装置略
夹持、加热等装置略![]()
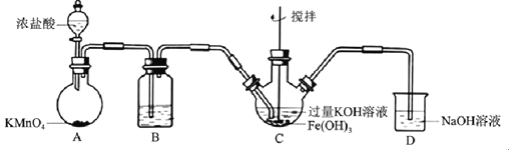
![]() 中所用试剂为______。
中所用试剂为______。
![]() 中反应为放热反应,而反应温度须控制在
中反应为放热反应,而反应温度须控制在![]() ,可使用的控温方法为______,充分反应后得到紫色固体,反应方程式为______。反应中KOH必须过量的原因是______。
,可使用的控温方法为______,充分反应后得到紫色固体,反应方程式为______。反应中KOH必须过量的原因是______。
![]() 中混合物经过滤、洗涤、干燥,得纯浄髙铁酸钾晶体,洗涤时洗涤剂可选用______。
中混合物经过滤、洗涤、干燥,得纯浄髙铁酸钾晶体,洗涤时洗涤剂可选用______。
![]() 冰水
冰水![]() 溶液
溶液![]() 异丙醇
异丙醇
Ⅱ![]() 探究
探究![]() 的性质
的性质
![]() 可以将废水中的
可以将废水中的![]() 氧化为
氧化为![]() ,实验表明,
,实验表明,![]() 时
时![]() 去除效果最佳。配平反应离子方程式:
去除效果最佳。配平反应离子方程式:
______![]() ______
______![]() ______
______![]() ______
______![]() ______
______![]() ______
______![]() 。现处理含
。现处理含![]() 离子浓度为
离子浓度为![]() 的废水
的废水![]() ,至少需要
,至少需要![]() ______g。
______g。
![]() 资料表明,酸性溶液中氧化性
资料表明,酸性溶液中氧化性![]() 验证实验:将少量
验证实验:将少量![]() 溶解在过量KOH溶液中,溶液呈浅紫色,取该溶液滴入
溶解在过量KOH溶液中,溶液呈浅紫色,取该溶液滴入![]() 和
和![]() 的混合溶液中,振荡,溶液颜色仍然呈浅紫色。请设计实验证明最后所得浅紫色溶液中含有
的混合溶液中,振荡,溶液颜色仍然呈浅紫色。请设计实验证明最后所得浅紫色溶液中含有![]() ______。
______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知阿司匹林(![]() )是一种常见药物,其中一种合成路线:
)是一种常见药物,其中一种合成路线:
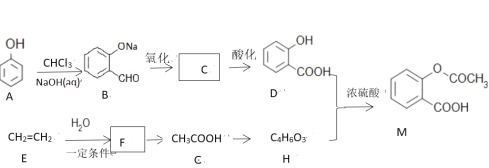
已知:酸酐更易与醇或酚发生酯化反应,已知甲酸酐为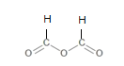
(1)写出M所含官能团名称:______________,E生成F的反应类型为:________________。
(2)写出物质B与银氨溶液的反应方程式:___________________。
(3)物质A生成B的过程中还有可能生成另一种苯环的二取代产物为:___________。
(4)物质B到D先氧化后酸化的原因是:_________________,符合下列条件D的同分异构体有多少种:_________。
a.遇到FeCl3会显紫色 b.可以发生银镜反应
(5)写出D+H→M的反应方程式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F是合成一种天然茋类化合物的重要中间体,其合成路线如下:

(1)A中含氧官能团的名称为________和________。
(2)A→B的反应类型为________。
(3)C→D的反应中有副产物X(分子式为C12H15O6Br)生成,写出X的结构简式:________。
(4)C的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:________。
①能与FeCl3溶液发生显色反应;
②碱性水解后酸化,含苯环的产物分子中不同化学环境的氢原子数目比为1∶1。
(5)已知: (R表示烃基,R'和R"表示烃基或氢),写出以
(R表示烃基,R'和R"表示烃基或氢),写出以 和CH3CH2CH2OH为原料制备
和CH3CH2CH2OH为原料制备 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。________________________
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.向稀醋酸溶液中加入少量醋酸钠固体,醋酸的电离程度增大
B.电镀时,通常把待镀金属制品作阳极,镀层金属作阴极
C.常温下,2NO2(g)=2NO(g)+O2(g)不能自发进行,则该反应的ΔH>0
D.工业通过反应“Na(l)+KCl(l)![]() NaCl(l)+K(g)”冶炼钾、说明钠的金属性强于钾
NaCl(l)+K(g)”冶炼钾、说明钠的金属性强于钾
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com