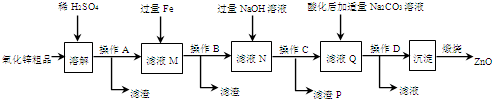
最近我国在用磷铵副产物磷石音制硫酸并联产水泥的技术方面获得重大突破,利用生产磷铵排放的废渣磷石膏制硫酸并联产水泥,硫酸返回用于生产磷铵化肥.其生产流程如下:
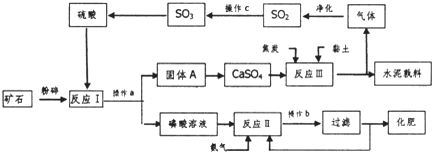
反应M的主要反应之一为:2CaSO
4+C
2CaO+2SO
2↑+CO
2↑试回答下列问题:
(1)完成反应I:Ca(PO
4)
3F+5H
2SO
4+
□═3H
3SO
4+5(CaSO
4?2H
2O)+□
.
(2)反应n的生成物是两种酸式盐的混合物,若两者物质的量之比为1:1,则参加反应的H
3PO
4与NH
3的物质的量之比为
.
(3)化验室要测定固体A中的生石音(化学式为CaSO
4?QH
2O)的含量(固体A中其余物质受热不分解).
已知:CaSO
4?2H
2O
CaSO
4?
H
2O+
H
2O CaSO
4?
H
2O
CaSO
4+
H
2O
①把固体A放徉坩埚中至少加热到
℃,为了得到正确的实验结果,实验中至少要进行
(填数字)次称量;
②若实验前取a g固体A,实验后固体物质的质量为b g,则样品中生石膏的质量分数为
.(用含a、b的关系式表示)
(4)在硫酸工业中,操作c是在
(填设备名称)中进行,在燃料煤中掺入CaO,可消除SO
2对大气的污染,同时获CaSO
4,试用一个化学方程式表示消除SO
2污染的原理
.




 阅读快车系列答案
阅读快车系列答案 Sn(s、白)△H3=+2.1kJ/mol,下列说法正确的是( )
Sn(s、白)△H3=+2.1kJ/mol,下列说法正确的是( )
 -R+HX
-R+HX -R
-R -COOH
-COOH