
 Sn(s、白)△H3=+2.1kJ/mol,下列说法正确的是( )
Sn(s、白)△H3=+2.1kJ/mol,下列说法正确的是( )| A、△H1>△H2 |
| B、锡制器皿长期处于低于13.2℃的环境中,会自行毁坏 |
| C、锡在常温下以灰锡状态存在 |
| D、灰锡转化为白锡的反应是放热反应 |
 Sn(s、白)△H3=+2.1kJ?mol-1,则②-①=③,所以△H2-△H1=△H3>0,所以△H1<△H2,故A错误;
Sn(s、白)△H3=+2.1kJ?mol-1,则②-①=③,所以△H2-△H1=△H3>0,所以△H1<△H2,故A错误; Sn(s、白)△H3=+2.1kJ?mol-1,当温度低于13.2℃的环境时,白锡会转化为灰锡,灰锡为粉末状,所以会自行毁坏,故B正确;
Sn(s、白)△H3=+2.1kJ?mol-1,当温度低于13.2℃的环境时,白锡会转化为灰锡,灰锡为粉末状,所以会自行毁坏,故B正确; Sn(s,白)△H3=+2.1kJ?mol-1,则锡在常温下以白锡状态存在,故C错误;
Sn(s,白)△H3=+2.1kJ?mol-1,则锡在常温下以白锡状态存在,故C错误; Sn(s,白)△H3=+2.1kJ?mol-1,焓变大于0,所以灰锡转为白锡的反应是吸热反应,故D错误.
Sn(s,白)△H3=+2.1kJ?mol-1,焓变大于0,所以灰锡转为白锡的反应是吸热反应,故D错误.

科目:高中化学 来源: 题型:
| A、4℃时,5.4mL水中所含的水分子数是0.3NA(4℃时,水的密度为1.0g/ml) |
| B、在常温常压下,11.2L氯气所含的原子数为NA |
| C、标准状况下,22.4L氢气所含的质子数为 NA |
| D、2L 1mol?L-1K2SO4溶液中离子的总数为3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X的氢化物溶于水显酸性 |
| B、X与Y形成化合物的化学式为X2Y3 |
| C、Y的氧化物是离子化合物 |
| D、X和Z的最高价氧化物对应的水化物都是弱酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3-n |
| 2 |

| n(OH-) |
| 3n(Fe) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铜溶于稀硝酸:Cu+2H++NO3-=Cu2++NO2↑+H2O |
| B、氯气和水的反应:Cl2+H2O=2H++Cl-+ClO- |
| C、用氨水溶解氯化银沉淀:Ag++2NH3?H2O=[Ag(NH3)2]++2H2O |
| D、将过量二氧化硫通入氨水中:SO2+NH3?H2O=HSO3-+NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
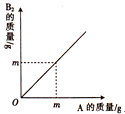 已知反应aA+B2=aAB,M(A)、M(B2)、M(AB)分别表示A、B2和AB的摩尔质量,其单位均为g/mol.A与B2反应的质量关系如图所示.下列说法中正确的是( )
已知反应aA+B2=aAB,M(A)、M(B2)、M(AB)分别表示A、B2和AB的摩尔质量,其单位均为g/mol.A与B2反应的质量关系如图所示.下列说法中正确的是( )| A、无法确定计量数a的大小 |
| B、M(A)=2M(B2) |
| C、M(AB)=2M(A)+M(B2) |
| D、若有6g A完全反应,则生成AB的质量为12g |
查看答案和解析>>
科目:高中化学 来源: 题型:
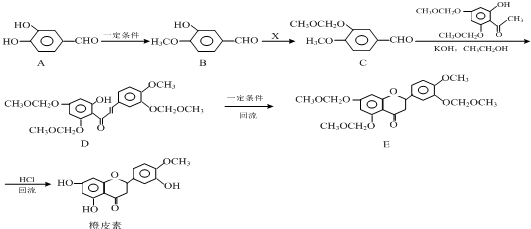
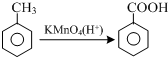 结合流程信息,写出以对甲基苯酚和上述流程中的“X”为原料,制备
结合流程信息,写出以对甲基苯酚和上述流程中的“X”为原料,制备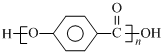 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:| HBr |
| NaOH溶液 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4+、NO3-、K+、SO42- |
| B、CO32_、NO3-、HCO3-、Na+ |
| C、Na+、ClO-、AlO2-、NO3- |
| D、MnO4-、K+、Na+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
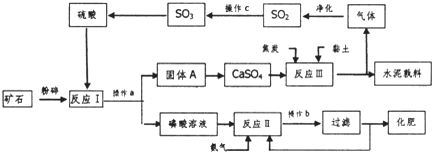
| ||
| ||
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| ||
| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com