
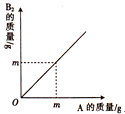
 已知反应aA+B2=aAB,M(A)、M(B2)、M(AB)分别表示A、B2和AB的摩尔质量,其单位均为g/mol.A与B2反应的质量关系如图所示.下列说法中正确的是( )
已知反应aA+B2=aAB,M(A)、M(B2)、M(AB)分别表示A、B2和AB的摩尔质量,其单位均为g/mol.A与B2反应的质量关系如图所示.下列说法中正确的是( )| A、无法确定计量数a的大小 |
| B、M(A)=2M(B2) |
| C、M(AB)=2M(A)+M(B2) |
| D、若有6g A完全反应,则生成AB的质量为12g |


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:
| A、4.6g 由NO2和N2O4组成的混合物中含有氧原子的数目为 0.2NA |
| B、1 mol Na2O2固体中含离子总数为4NA |
| C、标准状况下,1.12LCCl4含有C-Cl键的数目为0.2NA |
| D、将0.1mol FeCl3溶于 1L水中,所得溶液中含有0.1NA个Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
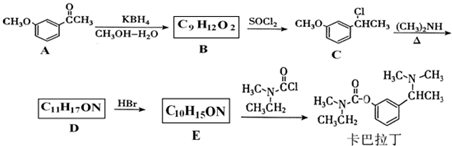
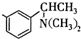 基团 ②属于α-氨基酸 ③含有三个手性碳原子.
基团 ②属于α-氨基酸 ③含有三个手性碳原子.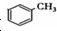 )和丙酮(
)和丙酮(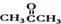 ) 制备化合物
) 制备化合物 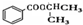 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH| 浓硫酸 |
| 170℃ |
| Br2 |
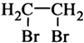
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 Sn(s、白)△H3=+2.1kJ/mol,下列说法正确的是( )
Sn(s、白)△H3=+2.1kJ/mol,下列说法正确的是( )| A、△H1>△H2 |
| B、锡制器皿长期处于低于13.2℃的环境中,会自行毁坏 |
| C、锡在常温下以灰锡状态存在 |
| D、灰锡转化为白锡的反应是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
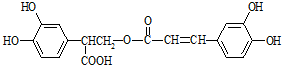 ,以邻苯二酚为原料合成迷迭香酸的路线为:
,以邻苯二酚为原料合成迷迭香酸的路线为: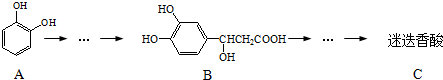
| A、有机物A分子中所有原子一定在同一平面上 |
| B、有机物C在浓硫酸催化下水解的一种产物是B |
| C、有机物B可以发生取代、加成、消去、氧化反应 |
| D、1 mol迷迭香酸分别与足量的NaOH溶液、浓溴水反应,最多可消耗NaOH、Br2均为6 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N2O4和NO2的分子数比为1:2 |
| B、N2O4和NO2的浓度相等 |
| C、单位时间内1 mol N2O4消耗的同时有2 mol NO2生成 |
| D、平衡体系的颜色不再改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
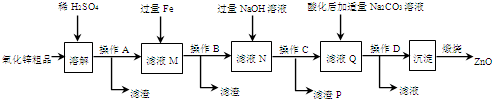
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com