
【题目】短周期元素X、Y、Z、W的原子序数依次增大,由四种元素组成的单质或化合物A、B、C、D、E、F、G之间的相互转化关系如图所示(反应条件已略去),其中仅B为单质,D为淡黄色固体,A广泛存在于沼气中。下列说法不正确的是( )

A.简单离子半径:Z>W
B.简单氢化物的稳定性:Z>Y
C.D、F、G中所含的化学键类型完全相同
D.1molD分别与足量C或E反应时,转移的电子数目均为NA
【答案】C
【解析】
短周期元素X、Y、Z、W的原子序数依次增大,由四种元素组成的单质或化合物A、B、C、D、E、F、G之间的相互转化关系如图所示(反应条件已略去),其中仅B为单质,D为淡黄色固体,D为Na2O2,A广泛存在于沼气中,A为CH4,综合转化关系:X为H,Y为C,Z为O,W为Na;A为CH4,B为O2,C和E分别为CO2或H2O,D为Na2O2,F和G为Na2CO3或NaOH。
A.简单离子半径:O2->Na+,故A正确;
B.简单氢化物的稳定性:H2O>CH4,故B正确;
C.D为Na2O2,含有离子键和非极性共价键,F和G为Na2CO3或NaOH,含有离子键和极性共价键,D、F、G中所含的化学键类型不完全相同,故C错误;
D.1molNa2O2分别与足量CO2或H2O反应时,转移的电子数目均为NA,故D正确;
故选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】化合物N具有镇痛、消炎等药理作用,其合成路线如下:
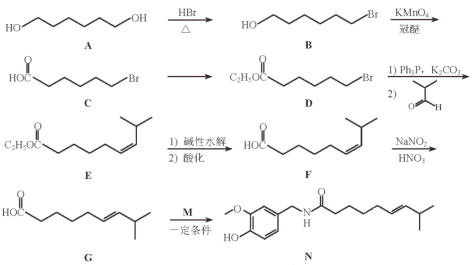
(1)A的系统命名为________________________。
(2)从A→B的反应所得液态有机混合物中提纯B的常用方法为____________。
(3)F与G的关系为(填序号)____________。
a.碳链异构 b.官能团异构 c.顺反异构 d.位置异构
(4)C→D的化学方程式为_______________________________________。
(5)M的结构简式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)广泛应用于纸浆漂白、杀菌消毒和水净化处理等领域。工业上利用甲醇还原NaClO3的方法制备ClO2,工艺流程如下:
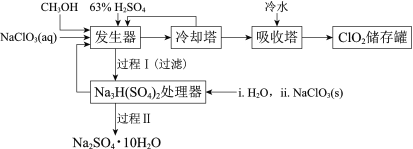
已知:a.发生器中制备ClO2的反应:12NaClO3+8H2SO4+3CH3OH= 12ClO2↑+3HCOOH+4Na3H(SO4)2↓+9H2O
b.相关物质的熔沸点:
物质 | CH3OH | HCOOH | ClO2 |
熔点/℃ | -97 | 9 | -59 |
沸点/℃ | 65 | 101 | 11 |
(1)ClO2可用于纸浆漂白、杀菌消毒是因其具有______性。
(2)冷却塔用于分离ClO2并回收CH3OH,应控制的最佳温度为______(填字母)。
A.0~10℃ B.20~30℃ C.60~70℃
(3)经过程Ⅰ和过程Ⅱ可以获得芒硝(Na2SO4·10H2O)并使部分原料循环利用。
已知:Na2SO4·10H2O和Na2SO4的溶解度曲线如下图:
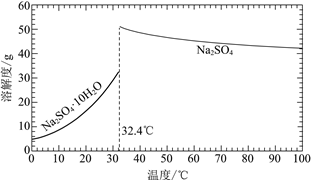
①Na3H(SO4)2处理器中获得芒硝时需加入NaClO3固体,从芒硝溶解平衡的角度解释其原因:______。
②结合Na2SO4·10H2O和Na2SO4的溶解度曲线,过程Ⅱ的操作是:在32.4℃恒温蒸发,______。
③Na3H(SO4)2处理器的滤液中可以循环利用的原料是NaClO3和______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. 水电离出的c(H+)·c(OH-)=10-22的溶液:K+、Na+、SO42-、S2O32-
B. 澄清透明溶液:Mg2+、Cu2+、Cl-、SO42-
C. 使酚酞变红色的溶液:NH4+、K+、AlO2-、SO32-
D. 含0.1 mol·L-1 KI的溶液:Fe3+、Na+、NO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
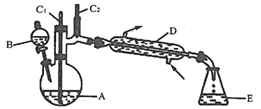
【题目】实验室可利用环己醇的氧化反应制备环己酮,反应原理和实验装置(部分夹持装置略)如图:
![]()
![]()
![]()
有关物质的物理性质见表。
物质 | 沸点(℃) | 密度(g·cm3,20℃) | 溶解性 |
环己醇 | 161.1(97.8)* | 0.96 | 能溶于水和醚 |
环己酮 | 155.6(95.0)* | 0.95 | 微溶于水,能溶于醚 |
水 | 100.0 | 1.0 |
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点。
实验通过装置B将酸性Na2Cr2O7溶液加到盛有10mL环己醇的A中,55~60℃进行反应。反应完成后,加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮粗品和水的混合物。
(1)装置D的名称为___________。
(2)酸性Na2Cr2O7溶液氧化环己醇反应的H<0,反应剧烈将导致体系温度迅速上升,副反应增多。
①滴加酸性Na2Cr2O7溶液时反应的离子方程式__________;
②蒸馏不能分离环己酮和水的原因是____________。
(3)环己酮的提纯需要经过以下一系列的操作:
a.蒸馏、除去乙醚后,收集151~156℃馏分
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c.过滤
d.往液体中加入NaCl固体至饱和,静置,分液
e.加入无水MgSO4固体,除去有机物中少量的水
①上述提纯步骤的正确顺序是_____________;
②b中水层用乙醚萃取的目的是___________;
③上述操作c、d中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需要的玻璃仪器有_______,操作d中,加入NaCl固体的作用是____________。
(4)恢复至室温时,分离得到纯产品体积为6mL,则环已酮的产率____________。(计算结果精确到0.1%)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有大量的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下图:
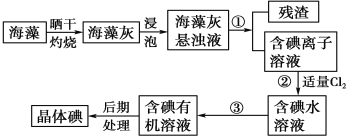
(1)实验室焙烧海带,需要下列仪器中的________(填序号)。
a 试管 b 烧杯 c 坩埚 d 泥三角 e 铁三脚架 f 酒精灯
(2)指出提取碘的过程中有关的实验操作名称:①__________,③________。
(3)提取碘的过程中,可选择的有机试剂是(_______)
A 甲苯、酒精 B 四氯化碳、苯
C 汽油、乙酸 D 汽油、甘油
(4)为使海藻灰中碘离子转化为碘的有机溶液,实验室有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,尚缺少的玻璃仪器有__________、__________。
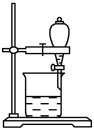
(5)小组用CCl4萃取碘水中的碘,在右图的分液漏斗中,下层液体呈__________色;
(6)从含碘的有机溶液中提取碘和回收有机溶剂,还须经过蒸馏,指出下面实验装置图中的错误之处:
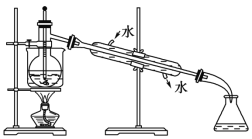
①____________________;
②_______________________________;
③____________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水AlCl3易升华,可用作有机合成的催化剂等.工业上用铝土矿(Al2O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下:

(1)氧化炉中Al2O3、Cl2和C反应的化学方程式______.
(2)用Na2SO3溶液可除去冷却器排出的尾气中的Cl2,此反应的离子方程式______.
(3)为了测定制得的无水AlCl3产品(含杂质FeCl3)的纯度,称取16.25g无水AlCl3样品,溶于过量的NaOH溶液中,过滤出沉淀物,再洗涤、灼烧、冷却、称重、得其质量为0.32g。
①写出上述测定过程中涉及的离子方程式:______、__________。
②AlCl3产品的纯度为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M(结构式如图所示)是常用的还原剂,由H·C·Brown和Schlesinger于1942年在芝加哥大学发现。其中X、Y、Z是原子序数依次减小的不同短周期主族元素,X与W、Z与W均能形成原子个数比为1:1和2:1的化合物,W原子的最外层电子数是电子层数的3倍。下列叙述正确的是
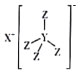
A.Z元素位于第三周期第Ⅶ A族
B.Y的最高价氧化物对应的水化物是一种一元弱酸
C.X和Z形成的化合物的水溶液呈酸性
D.化合物M不能与Z2W2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究草酸(H2C2O4)性质,进行如下实验。(已知:室温下,0.1 mol·L1 H2C2O4的pH=1.3)
实验 | 装置 | 试剂a | 现象 |
① |
| Ca(OH)2溶液(含酚酞) | 溶液褪色,产生白色沉淀 |
② | 少量NaHCO3溶液 | 产生气泡 | |
③ | 酸性KMnO4溶液 | 紫色溶液褪色 | |
④ | C2H5OH和浓硫酸 | 加热后产生有香味物质 |
由上述实验所得草酸性质所对应的方程式不正确的是
A. H2C2O4有酸性,Ca(OH)2+ H2C2O4![]() CaC2O4↓+2H2O
CaC2O4↓+2H2O
B. 酸性:H2C2O4> H2CO3,NaHCO3+ H2C2O4![]() NaHC2O4+CO2↑+H2O
NaHC2O4+CO2↑+H2O
C. H2C2O4具有还原性,2![]() +5
+5![]() +16H+
+16H+![]() 2Mn2++10CO2↑+ 8H2O
2Mn2++10CO2↑+ 8H2O
D. H2C2O4可发生酯化反应,HOOCCOOH+2C2H5OH![]() C2H5OOCCOOC2H5+2H2O
C2H5OOCCOOC2H5+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com