
【题目】无水AlCl3易升华,可用作有机合成的催化剂等.工业上用铝土矿(Al2O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下:

(1)氧化炉中Al2O3、Cl2和C反应的化学方程式______.
(2)用Na2SO3溶液可除去冷却器排出的尾气中的Cl2,此反应的离子方程式______.
(3)为了测定制得的无水AlCl3产品(含杂质FeCl3)的纯度,称取16.25g无水AlCl3样品,溶于过量的NaOH溶液中,过滤出沉淀物,再洗涤、灼烧、冷却、称重、得其质量为0.32g。
①写出上述测定过程中涉及的离子方程式:______、__________。
②AlCl3产品的纯度为___________。
【答案】Al2O3+3Cl2+3C ![]() 2AlCl3+3CO SO32-+Cl2+H2O=SO42-+2Cl-+2H+ Fe3++3OH-=Fe(OH)3↓ Al3++4OH-=AlO2-+2H2O 96%
2AlCl3+3CO SO32-+Cl2+H2O=SO42-+2Cl-+2H+ Fe3++3OH-=Fe(OH)3↓ Al3++4OH-=AlO2-+2H2O 96%
【解析】
(1)根据工艺流程可知氯化炉的产物,经冷却、升华可制备无水AlCl3,说明氯化炉的产物中含有A1C13,冷凝器尾气含有CO,所以Al2O3、C12和C反应,生成A1C13和CO,反应方程式为Al2O3+3Cl2+3C ![]() 2AlCl3+3CO;(2)Cl2有强氧化性,将SO32-氧化为SO42-,自身被还原为Cl-。反应离子方程式为SO32-+Cl2+H2O=SO42-+2Cl-+2H+;(3)①除杂过程中铁离子与氢氧根离子结合成氢氧化铁沉淀,铝离子与氢氧根离子结合成偏铝酸根和水,离子方程式为:Fe3++3OH-=Fe(OH)3↓、Al3++4OH-=AlO2-+2H2O;
2AlCl3+3CO;(2)Cl2有强氧化性,将SO32-氧化为SO42-,自身被还原为Cl-。反应离子方程式为SO32-+Cl2+H2O=SO42-+2Cl-+2H+;(3)①除杂过程中铁离子与氢氧根离子结合成氢氧化铁沉淀,铝离子与氢氧根离子结合成偏铝酸根和水,离子方程式为:Fe3++3OH-=Fe(OH)3↓、Al3++4OH-=AlO2-+2H2O;
②根据铁原子守恒,令含有杂质FeCl3质量为m,则:
Fe2O3~~~~~2FeCl3
160 325
0.32g m
![]() =
=![]() ,解得:m=0.65g,
,解得:m=0.65g,
所以AlCl3产品的纯度为![]() ×100%=96%。
×100%=96%。


科目:高中化学 来源: 题型:
【题目】A、B、C、是中学化学中常见的物质,它们之间的转化关系如图所示(部分产物已略去):

请回答下列问题:
(1)若X是强氧化性单质,则A不可能是_____(填序号)。
a.C b.N2 c.S d.Na e.Mg
(2)若B是能使品红试液褪色的无色气体,则B转化为C的化学方程式为:_____。
(3)若A、B、C三种化合物的水溶液均呈酸性,写出A和B反应的化学方程式:_____。C溶于水会生成D,D的浓溶液与铜加热时反应产生了1.12L气体(标况下),则被还原的D的物质的量是_____mol,转移的电子数是个_____。
(4)若X是金属单质,向B、C的溶液中分别滴加AgNO3溶液和稀硝酸均产生白色沉淀,则B的化学式是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验现象所得出的结论正确的是
选项 | 实验现象 | 实验结论 |
A | 将铝片分别投入浓、稀硝酸中,前者无明显现象,后者反应剧烈 | 稀硝酸的氧化性比浓硝酸的强 |
B | 滴有酚酞的Na2CO3溶液中加入BaCl2溶液,红色变浅 | Na2CO3溶液中存在水解平衡 |
C | 某溶液中滴加过量氨水产生白色沉淀且不溶解 | 该溶液中一定含有Mg2+ |
D | 溴水中通入SO2,溴水褪色 | SO2具有漂白性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以乙烯为原料,在一定条件下可以转化为A、B、C,最后合成有机化合物D,转化关系如下图所示:

请回答:
(1)写出有机物B的官能团名称:________________。
(2)写出CH3=CH2→A化学方程式:________________。
(3)有机化合物D的相对分子质量为:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关Na2CO3和NaHCO3的叙述中正确的是
A. 向Na2CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原Na2CO3的物质的量之比为1:2
B. 等质量的NaHCO3和Na2CO3分別与足量盐酸反应,在同温同压下。生成的CO2体积相同
C. 物质的量浓度相同时,Na2CO3溶液的pH小于NaHCO3溶液
D. 向Na2CO3饱和溶液中通入CO2有NaHCO3结晶析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2]是分析化学中的重要试剂,在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在500℃时隔绝空气加热A中的硫酸亚铁铵至分解完全。确定分解产物的成分。

(1)B装置的作用是__________。
(2)实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定产物中定有______气体产生,写出D中发生反应的离子方程式__________。若去掉C,是否能得出同样结论并解释其原因_____________。
(3)A中固体完全分解后变为红宗色粉末,某同学设计实验验证固体残留物仅为Fe2O3.而不含FeO。请完成表内容。(试剂,仅然和用品自选)
实验步骤 | 预期现象 | 结论 |
取少量A中残留物于试管中,加入适量稀硫酸,充分振荡使其完全溶解:_________ | ___________ | 固体残留物仅为Fe2O3 |
(4)E中收集到的气体只有N2,其物质的量为xmol,固体残留物刚体死目物Fe2O3的物质的量为ymol,D中沉淀物质的量为zmol,根据氧化还原反应的基本规律,x、y和z应满足的关系为________。
(5)结合上述实验现象和相关数据的分析。写出硫酸亚铁铵在500℃时隔绝空气加热完全分解的化学方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是镁-空气燃料电池工作原理示意图,电池总反应为2Mg+O2+2H2O=2Mg(OH)2。下列有关该电池的说法正确的是( )
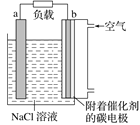
A.a极为负极,发生还原反应
B.b电极上电极反应:O2+2H2O+4e-=4OH-
C.工作时电子由b极经外电路流向a极
D.该装置实现了电能转化成化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点。如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒。当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流。试回答下列问题:

(1)氢气进入的这极为___极;
(2)写出氢氧燃料电池工作时的正极反应式:___;
(3)该氢氧燃料电池每转移0.1mol电子,消耗标准状态下___L氧气;
(4)若将此燃料电池改进为直接以甲烷和氧气为原料进行工作时,负极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 用牺牲阳极的阴极保护法保护船舶时,将船舶与石墨相连
B. 往含硫酸的淀粉水解液中,先加氢氧化钠溶液,再加碘水,检验淀粉是否水解完全
C. 反应3Si(s)+2N2(g)=Si3N4(s)能自发进行,则该反应的△H<0
D. 已知BaSO4的Ksp= (Ba2+ )·c(SO42-),所以BaSO4在硫酸钠溶液中溶解达到饱和时有c(Ba2+)=c(SO42-)=![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com