
【题目】用下列实验装置进行相应实验,能达到实验目的是( )
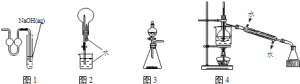
A.用图1装置作为制取二氧化碳的尾气吸收装置
B.用图2装置进行二氧化碳喷泉实验
C.用图3装置进行二氧化锰和浓盐酸制取氯气的实验
D.用图4装置进行石油的分馏实验
 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:
【题目】CH4超干重整CO2技术可得到富含CO的化工原料。回答下列问题
(1)CH4超干重整CO2的催化转化如图所示:

①关于上述过程Ⅱ的说法不正确的是________(填序号)。
a.实现了含碳物质与含氢物质的分离
b.可表示为CO2+H2===H2O(g)+CO
c.CO未参与反应
d.Fe3O4、CaO为催化剂,降低了反应的ΔH
②其他条件不变,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,反应CH4(g)+CO2(g)===2CO(g)+2H2(g)进行相同时间后,CH4的转化率随反应温度的变化如图所示。a点所代表的状态________(填“是”或“不是”)平衡状态;b点CH4的转化率高于c点,原因是____________________________________________________________。

(2)在一刚性密闭容器中,CH4和CO2的分压分别为20 kPa、25 kPa,加入Ni/α-Al2O3催化剂并加热至1 123 K使其发生反应CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
①研究表明CO的生成速率v(CO)=1.3×10-2·p(CH4)·p(CO2) mol·g-1·s-1,某时刻测得p(CO)=20 kPa,则p(CO2)=________kPa,v(CO)=________mol·g-1·s-1。
②达到平衡后测得体系压强是起始时的1.8倍,则该反应的平衡常数的计算式为Kp=________(kPa)2。(用各物质的分压代替物质的量浓度计算)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1 mol·L-1Na2S2O3溶液和0.1 mol·L-1H2SO4溶液各5 mL,与10 mL水混合,反应速率为v1mol·L-1·s-1;0.2 mol·L-1Na2S2O3溶液和0.2 mol·L-1H2SO4溶液各5 mL,与20 mL水混合,反应速率为v2mol·L-1·s-1。则v1和v2的关系是( )
A.v1>v2
B.v1<v2
C.v1=v2
D.不能肯定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组为证明在同温同压下,相同浓度相同体积的酸性不同的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积。设计的简易实验装置如下图。该实验的主要操作步骤如下:

①配制浓度均为1 mol/L盐酸和醋酸溶液;
②用______________量取10.00 mL 1mol/L盐酸和醋酸溶液分别加入两个锥形瓶中;
③分别称取除去表面氧化膜的镁带a g,并系于铜丝末端,a的数值至少为______________;
④在广口瓶中装足量的水,按图连接好装置;检查装置的气密性;
⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触),至反应完全,记录______________;
⑥反应结束后,待温度恢复到室温,若丙中液面高于乙中液面,读取量筒中水的体积前,应______________,读出量筒中水的体积为V mL。
请将上述步骤补充完整并回答下列问题:
⑴用文字表述④检查该装置气密性的操作与观察方法:______________。
⑵本实验中应选用______________(填序号)的量筒。
A、100 mL B、200 mL C、500 mL
⑶若水蒸气的影响忽略不计,在实验室条件下,气体摩尔体积的计算式为:Vm=______________。
⑷简述速率不等的原因______________铜丝不与酸接触的原因______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将N2、H2混合气体100 mL通入密闭容器内,达到平衡时,容器内的压强比反应前减小![]() ,测得此时混合气体的平均相对分子质量为9。试求:
,测得此时混合气体的平均相对分子质量为9。试求:
(1)原混合气中N2、H2各多少毫升______?
(2)H2的转化率是多少______?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )

A. a通入CO2,然后b通入NH3,c中放碱石灰
B. b通入NH3,然后a通入CO2,c中放碱石灰
C. a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
D. b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氢硅(SiHCl3)是光伏产业的一种关键化学原料,制备反应的方程式为Si(s)+3HCl(g)![]() SiHCl3(g)+H2(g),同时还有其他副反应发生。当反应体系的压强为0.05 MPa时,分别改变进料比[n(HCl)∶n(Si)]和反应温度,二者对SiHCl3产率影响如图所示。下列说法正确的是
SiHCl3(g)+H2(g),同时还有其他副反应发生。当反应体系的压强为0.05 MPa时,分别改变进料比[n(HCl)∶n(Si)]和反应温度,二者对SiHCl3产率影响如图所示。下列说法正确的是
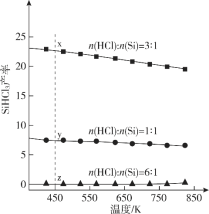
A. 降低压强有利于提高SiHCl3的产率
B. 制备SiHCl3的反应为放热反应
C. 温度为450 K,平衡常数:K(x)>K (y)>K (z)
D. 增加HCl的用量,SiHCl3的产率一定会增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1molH2(g)和2molI2(g)置于某2L密闭容器中,在一定温度下发生如下反应,并达到平衡:H2(g)+I2(g)![]() 2HI(g)+Q(Q>0)。HI的体积分数HI%随时间变化如曲线(Ⅰ)所示,若改变反应条件,HI%的变化如曲线(Ⅱ)所示,则改变的条件可能是( )
2HI(g)+Q(Q>0)。HI的体积分数HI%随时间变化如曲线(Ⅰ)所示,若改变反应条件,HI%的变化如曲线(Ⅱ)所示,则改变的条件可能是( )
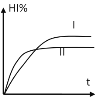
A.恒温条件下,加入适当催化剂
B.恒温条件下,缩小反应容器体积
C.恒容条件下升高温度
D.恒温条件下,扩大反应容器体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫元素最常见和最稳定的一种同素异形体是黄色的正交α-型,1912年E.Beckmann由硫在碘中的冰点降低法测得它含有S8分子。1891年,M.R.Engel用浓盐酸和硫代硫酸盐的饱和溶液在0℃下作用首次制得了一种菱形的![]() -硫,后来证明含有S6分子。下列说法正确的是
-硫,后来证明含有S6分子。下列说法正确的是
A.S6和S8分子都是由S原子组成,所以它们是一种物质
B.S6和S8分子分别与铁粉反应,所得产物不同
C.S6和S8分子分别与过量的氧气反应可以得到SO3
D.等质量的S6和S8分子分别与足量的KOH反应,消耗KOH的物质的量相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com