
【题目】CH4超干重整CO2技术可得到富含CO的化工原料。回答下列问题
(1)CH4超干重整CO2的催化转化如图所示:

①关于上述过程Ⅱ的说法不正确的是________(填序号)。
a.实现了含碳物质与含氢物质的分离
b.可表示为CO2+H2===H2O(g)+CO
c.CO未参与反应
d.Fe3O4、CaO为催化剂,降低了反应的ΔH
②其他条件不变,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,反应CH4(g)+CO2(g)===2CO(g)+2H2(g)进行相同时间后,CH4的转化率随反应温度的变化如图所示。a点所代表的状态________(填“是”或“不是”)平衡状态;b点CH4的转化率高于c点,原因是____________________________________________________________。

(2)在一刚性密闭容器中,CH4和CO2的分压分别为20 kPa、25 kPa,加入Ni/α-Al2O3催化剂并加热至1 123 K使其发生反应CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
①研究表明CO的生成速率v(CO)=1.3×10-2·p(CH4)·p(CO2) mol·g-1·s-1,某时刻测得p(CO)=20 kPa,则p(CO2)=________kPa,v(CO)=________mol·g-1·s-1。
②达到平衡后测得体系压强是起始时的1.8倍,则该反应的平衡常数的计算式为Kp=________(kPa)2。(用各物质的分压代替物质的量浓度计算)
【答案】c、d 不是 b、c均未达到平衡,b点温度高,反应速率快,消耗CH4量多,故转化率高 15 1.95 ![]()
【解析】
(1)根据图示的反应历程分析反应中各物质的作用及总反应方程式;根据催化剂、温度对平衡移动的影响分析解答;(2)运用“三段式”法,结合题给信息中速率与压强间的关系进行相关计算;(3)根据平衡常数表达式,用平衡时反应物的压强计算平衡常数。
(1)①a.上述分析可知,两步反应实现了含碳物质与含氢物质的分离,故a正确;
b.反应过程中有催化剂和中间产物,总反应可表示为CO2+H2=H2O(g)+CO,故b正确;
c.CO最后剩余是一氧化碳参与反应过程最后又生成,故c错误;
d.Fe3O4、CaO为催化剂,改变反应速率不能改变反应的△H,故d错误;故答案为:cd;
②因为催化剂只改变反应速率不改变平衡移动,所以最终不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下达平衡时CH4的转化率相同,故a点所代表的状态不是平衡状态,此时反应一直向正反应方向移动,b和c都没平衡,c点温度高,反应速率快,相同时间内转化率高,所以c点CH4的转化率高于b点,故答案为:不是;b和c都没平衡,c点温度高,反应速率快,相同时间内转化率高;
(2)①在一刚性密闭容器中,CH4和CO2的分压分别为20kPa、25kPa,加入Ni/α-A12O3催化剂并加热至1123K使其发生反应:某时刻测得p(CO)=20kPa,
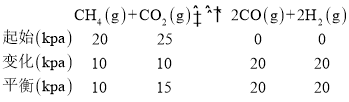
则p(CO2)=15kPa, v(CO)=1.3×10-2·p(CH4)·p(CO2) mol·g-1·s-1=1.3×10-2×10×15=1.95molg-1s-1,故答案为:15;1.95;
②CH4(g)+CO2(g)═2CO(g)+2H2(g),达到平衡后测得体系压强是起始时的1.8倍,设达到平衡状态消耗甲烷分压x:
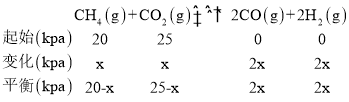
则20-x+25-x+2x+2x=(20+25)×1.8,x=18,反应的平衡常数的计算式为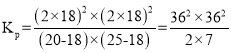 ,故答案为:
,故答案为:![]() 。
。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】某干电池的工作原理如图所示,总反应为:Zn+2NH4+=Zn2++2NH3↑+H2↑,下列说法正确的是( )
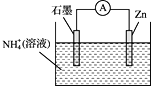
A.石墨为电池的负极B.电池工作时NH4+被氧化
C.实现了电能向化学能转化D.电子由Zn电极经外电路流向石墨电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院设计了一种新型的多功能复合催化剂,实现了CO2直接加氢制取高辛烷值汽油,其过程如图。下列有关说法正确的是( )
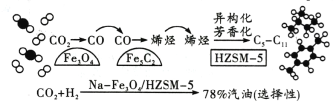
A.在Na-Fe3O4上发生的反应为CO2+H2=CO+H2O
B.中间产物Fe5C2的生成是实现CO2转化为汽油的关键
C.催化剂HZMS-5可以提高汽油中芳香烃的平衡产率
D.该过程,CO2转化为汽油的转化率高达78%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向圆底烧瓶中加入1 molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应;C2H5OH+HBr![]() C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
A. 加入NaOH,可增大乙醇的物质的量
B. 增大HBr浓度,有利于生成C2H5Br
C. 若反应物增大至2 mol,则两种反应物平衡转化率之比不变
D. 若起始温度提高至60℃,可缩短反应达到平衡的时间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应A2(g)+2B2(g)![]() 2AB2(g) ΔH<0,下列说法正确的是
2AB2(g) ΔH<0,下列说法正确的是
A. 达平衡后降低温度,混合气体平均相对分子质量减小
B. 使用催化剂能加快反应速率,缩短达平衡所需的时间且提高A2的转化率
C. 达平衡后升高温度并增大压强,有可能每一组分的百分含量都不改变,但平衡常数一定发生改变
D. 达平衡后,降低温度或减小压强都有利于该平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为﹣2价.如图所示为超氧化钾晶体的一个晶胞(晶体中最小的重复单元),则下列说法中正确的是

A. 晶体中每个K+周围有8个O2﹣,每个O2﹣周围有8个K+
B. 晶体中与每个K+距离最近的K+有8个
C. 超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O2﹣
D. 晶体中,0价氧与﹣2价氧的数目比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10mol·L-1的NaOH溶液滴定20.00mL浓度为0.10mol·L-1的HX溶液所得滴定曲线如下图(忽略溶液体积变化)。下列说法正确的是

A. 常温下K(HX)≈1×10-12
B. a点所示的溶液中:c(Na+)>c(X-)>c(OH-)=c(H+)
C. c点所示的溶液中:c(Na+)+c(HX)+c(X-)=0.10mol·L-1
D. 相同条件下,X-的水解能力弱于HX的电离能力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S2O3是一种弱酸,实验室欲用0.01 mol·L-1的Na2S2O3溶液滴定I2溶液,发生的反应为I2+2Na2S2O3===2NaI+Na2S4O6,下列说法合理的是( )
A.该滴定可用甲基橙作指示剂
B.Na2S2O3是该反应的还原剂
C.该滴定可选用如图所示装置

D.该反应中每消耗2 mol Na2S2O3,电子转移数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的是( )
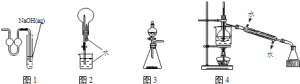
A.用图1装置作为制取二氧化碳的尾气吸收装置
B.用图2装置进行二氧化碳喷泉实验
C.用图3装置进行二氧化锰和浓盐酸制取氯气的实验
D.用图4装置进行石油的分馏实验
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com