
【题目】阅读下表短周期主族元素的相关系信息。
元素代号 | 相关信息 |
A | A的单质能与冷水剧烈反应,得到强碱性溶液 |
B | B的原子最外层电子数是其内层电子数的三倍 |
C | 在第3周期元素中,C的离子半径简单最小 |
D | A、B、D组成的36电子的化合物X是家用消毒剂的主要成分 |
E | 所有有机物中都含有E元素 |
请回答:
(1)写出E在元素周期表中的位置:_________;C的简单离子的结构示意图:__________。
(2)X的化学式为 。
(3)A、B、C三种元素的简单离子的半径由大到小的顺序为 (用离子符号表示)。
(4)A、B两元素组成的化合物A2B2属于 (填“离子”或“共价”“化合物”)。存在的化学键是 。
(5)C元素形成的单质能与A的最高价氧化物水合物反应,其离子方程式为 。
【答案】(1)第二周期第ⅣA族;![]() (2)NaClO(3)O2->Na+>Al3+(4)离子化合物,离子键、共价键(5)2Al+2OH-+2H2O=2AlO2-+3H2↑
(2)NaClO(3)O2->Na+>Al3+(4)离子化合物,离子键、共价键(5)2Al+2OH-+2H2O=2AlO2-+3H2↑
【解析】试题分析:短周期主族元素,A的单质能与冷水剧烈反应,得到强碱性溶液,则A为钠元素;B的原子最外层电子数是其内层电子数的三倍,B有2个电子层,最外层电子数为6,故B为氧元素;在第3周期元素中,C的简单离子半径最小,C为铝元素;A、B、D组成的36电子的化合物X是家用消毒剂的主要成分,X为NaClO,D为Cl元素;所有有机物中都含有E元素,E为碳元素。
(1)E为碳元素,原子有2个电子层,最外层电子数为4,处于周期表中第二周期第ⅣA族;C为铝元素,铝离子核外电子数为10,有2个电子层,最外层电子数为8,离子结构示意图为 ,故答案为:第二周期第ⅣA族;
,故答案为:第二周期第ⅣA族; ;
;
(2)有上述分析可知,X为NaClO,故答案为:NaClO;
(3)A、B、C三种元素形成的简单离子分别为Na+、O2-、Al3+,离子的电子层排布相同,核电荷数越大,离子半径越小,所以离子半径由大到小的顺序为O2->Na+>Al3+,故答案为:O2->Na+>Al3+;
(4)过氧化钠中含有活泼金属元素,属于离子化合物,存在离子键,过氧根中存在共价键,故答案为:离子化合物,离子键、共价键;
(5)铝与氢氧化钠反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法中正确的是 ( )
A. 1 L水中溶解了58.5gNaCl,该溶液的物质的量浓度为1 mol/L
B. 从1L2mol/L的H2SO4溶液中取出0.5L,该溶液的浓度为1mol/L
C. 配制500mL0.1 mol·L-1的CuSO4溶液,需8.0g 无水CuSO4
D. 中和100mL1mol/L的H2SO4溶液,需NaOH为4.0 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A经如图所示的过程转化为D。已知D为强酸或强碱,请回答下列问题:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
(1)若常温下C是红棕色的气体,则:
①A的化学式可能是:A__________,C转化D的过程中,氧化剂和还原剂的质量之比为______
②若A能使湿润的红色石蕊试纸变蓝,则A转化为B反应的化学方程式为____________________________________ 。
③D的浓溶液在常温下可与铜反应,请写出该反应的离子方程式________________________
(2)若A为金属单质,C为淡黄色固体,则C的电子式为_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg﹣AgCl 电池是一种能被海水激活的一次性贮备电池,电池反应方程式为:2AgCl+Mg═Mg2++2Ag+2Cl﹣ . 有关该电池的说法正确的是( )
A.Mg 为电池的正极
B.负极反应为 AgCl+e﹣=Ag+Cl﹣
C.可用于海上应急照明供电
D.电池工作时,电解质溶液质量不断减轻
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】被誉为改变未来世界十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点。如下图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒。当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
(1)通入氢气的一极为 __________ 极。
(2)写出氢氧燃料电池工作时正极电极反应方程式:________________________________。
(3)该氢氧燃料电池每转移0.3mol电子,消耗标准状态下 ________________L氧气。
(4)若将此燃料电池改进为直接以甲醇(CH3OH)和氧气为原料进行工作时,负极反应式为____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于化学反应3W(s)+2X(g)=4Y(g)+3Z(g),下列反应速率关系中,正确的是( )
A.v(W)=3v(Z)
B.2v(X)=3v(Z)
C.2v(X)=v(Y)
D.2v(W)=3v(X)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸钾用途较广,用于炸药、高级安全火柴、氧化剂及火箭、导弹推进剂等。工业制备氯酸钾有以下两种方法
方法一:电解热的饱和食盐水可以制得到氯酸钠,再与一定量的氯化钾进行复分解反应,即可得到硫酸钾,流程图如下:

(1)①盐水精制时所加四种试剂是为了除去粗盐水中含有的_______等杂质离子,需将粗盐溶解后,按顺序加入药品进行沉淀、过滤等。加入药品的顺序可以是_______________。
②加入足量纯碱时,会有部分BaSO4转化成BaCO3。若l.0L BaSO4的悬浊液中含0.010 mol BaSO4固体,需加入_______摩尔Na2CO3才能将BaSO4完全转化为BaCO3。 (已知/Ksp(BaSO4)=1.1×10-10,Ksp(BaCO3)=5.5×10-9)
(2)电解热饱和NaCl溶液的离子方程式为__________。 通电开始后,阴极附近溶液pH会________(填“增大”“减小”或“不变”)。
(3)过滤用到的三个玻璃仪器为________________________。
(4)过滤后滤液仍然浑浊的可能的操作原因:向漏斗中加液体时液面高于滤纸边缘;______________。
(5)将得到的氯酸钠与一定量的氯化钾进行复分解反应, KCl+NaC1O3 = KC1O3+NaCl。已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示。反应液经冷却至35℃以下时可析出氯酸钾晶体,原因是_______。在冷却降温析出KC1O3过程中,常伴有NaCl析出,分离出母液,将粗氯酸钾进行进一步提纯的方法是______________,操作步骤是蒸发浓缩、__________、过滤、洗涤、干燥,最后制得氯酸钾成品。

方法二:用热的石灰乳和氯气反应,再和氯化钾复分解反应制备:
(6)①C12转化为Ca(C1O3)2的化学方程式为_______________。
②提高Cl2转化为Ca(C1O3)2的转化率的可行措施有_________________。(填一条即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香豆素(![]() )可以看做是邻烃基肉桂酸的内酯,它是一大类存在于植物界中的香豆素类化合物的母核。下图是工业合成香豆素的两种方法:
)可以看做是邻烃基肉桂酸的内酯,它是一大类存在于植物界中的香豆素类化合物的母核。下图是工业合成香豆素的两种方法:
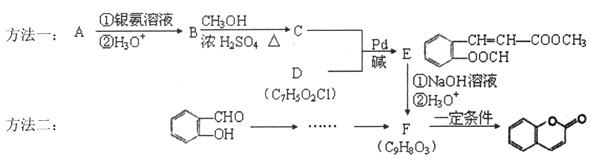
已知:
①
②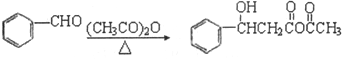
③(CH3CO)2O+H2O![]() 2CH3COOH
2CH3COOH
请回答:
(l)下列说法不正确的是_______。
A.化合物B、C容易被氧化
B.C与D反应生成E的反应类型是加成反应
C.在一定条件下,lmolD与NaOH充分反应最多消耗3mol NaOH
D.香豆素分子中所有原子共平面
(2)化合物A的结构简式是________
(3)写出符合下列条件的F的所有同分异构休的结构简式__________。
①1H-NMR谱显示苯环上有两种不同化学环境的氢原子
②能发生水解反应并能使溴的CCl4溶液褪色
③苯环侧链上无支链
(4)E![]() F的总化学方程式是__________
F的总化学方程式是__________
(5)请写出方法二中制备F的合成路线(用流程图表示,无机试剂任选,标注反应条件): __________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制物质的量浓度为0.1molL-1的Na2CO3溶液100 mL时,下列操作正确的是
A. 用托盘天平称取1.06 g 无水碳酸钠,在烧杯中加适量水溶解,待冷却到室温后,将溶液转移到容量瓶中
B. 在使用容量瓶前必须检查容量瓶是否完好以及瓶塞处是否漏水
C. 定容时,若加水超过刻度线,可用胶头滴管小心吸出多余部分
D. 定容时,若仰视,则所配溶液的浓度将偏高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com