
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为;
(2)反应是反应.(选填“吸热”、放热).
(3)能判断该反应是否达到化学平衡状态的依据是 .
a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)c(CH2)=c(CO)c(H2O),试判断此时的温度为℃
【答案】
(1)![]()
(2)吸热
(3)bc
(4)830
【解析】解:(1)因平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,所以 ![]() ;
;
(2)化学平衡常数的大小只与温度有关,升高温度,平衡向吸热的方向移动,由表可知:升高温度,化学平衡常数增大,说明化学平衡正向移动,因此正反应方向吸热;
(3)a、反应是一个反应前后体积不变的反应,压强的改变不会要引起平衡移动,故a错误;
b、化学平衡时,各组分的浓度不随时间的改变而改变,故b正确;
c、化学平衡状态的标志是v正=v逆,所以v正(H2)=v逆(H2O)表明反应达到平衡状态,故c正确;
d、c(CO2)=c(CO)时,不能表明正逆反应速率相等,不一定达到了平衡状态,故d错误.
(4)平衡浓度符合下式c(CO2)c(CH2)=c(CO)c(H2O)时,浓度熵和平衡常数相等均等于1,平衡常数只受温度的影响,当K=1时,根据表中数据,所以温度是830℃;
所以答案是:(1)![]() ;(2)吸热;(3)bc;(4)830
;(2)吸热;(3)bc;(4)830
【考点精析】认真审题,首先需要了解化学平衡常数的含义(指在一定条件下的可逆反应里,正反应和逆反应的速率相等,反应混合物中各组分的浓度不变的状态),还要掌握化学平衡状态的判断(状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等)的相关知识才是答题的关键.


科目:高中化学 来源: 题型:
【题目】下列有关物质性质的比较顺序中,不正确的是![]()
A. 热稳定性:HF<HCl<HBr<HI B. 微粒半径:K+>Na+>Mg2+>Al3+
C. 酸性:HClO4>H2SO4>H3PO4>H2SiO3 D. 最外层电子数:Li<Mg<Si<Ar
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮和氯元素及其化合物与人类的生产、生活密切相关。
I.碳的化合物的转换在生产、生活中具有重要的应用。特别是CO2的低碳转型对抵御气候变化具有重要意义。

在三个容积均为1L的密闭容器中以不同的氢碳比n(H2)/n(CO2)充入H2和CO2,在一定条件下发生反应:
2CO2(g) + 6H2(g) ![]() C2H4(g) + 4H2O(g) △H,CO2的平衡转化率与温度的关系如图所示(①、②、2.0分别代表三种氢碳比时的变化曲线)。
C2H4(g) + 4H2O(g) △H,CO2的平衡转化率与温度的关系如图所示(①、②、2.0分别代表三种氢碳比时的变化曲线)。
请回答下列问题:
(1)反应的△H_____0,氢碳比①________②,Q点v(正)_____v(逆)(填“大于”或“小于”)
(2)若起始时,CO2的浓度为0.5mol/L,氢气的浓度为1.0mol/L;则P点对应温度的平衡常数的值为_____________________。
II.氯的化合物合成、转化一直是科学研究的热点。
①一定条件下,氯气与氨气反应可以制备氯胺[NH2Cl(g)],已知部分化学键的键能:
则上述反应的热化学方程式为_______________________________________________________。
化学键 | N—H | Cl—Cl | N—Cl | H—Cl |
键能/kJ·mol-1 | 391.3 | 243.0 | 191.2 | 431.8 |
②氯胺是一种长效缓释含氯消毒剂,有缓慢而持久的杀菌作用,可以杀死H7N9禽流感病毒,其消毒原理为与水缓慢反应生成强氧化性的物质,该反应的化学方程式为
_________________________________________________________。
III.用氨水除去SO2
(1)已知25℃时,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8.若氨水的浓度为2.0mol/L,则溶液中的c(OH-)=_________mol/L.将SO2通入该氨水中,当c(OH-)降至1.0×10-7mol/L时,溶液中的c(SO32-)/c(HSO3-)=_____________.
(2)利用氨气与空气催化氧化法制取联氨N2H4.如图是由“联氨-空气”形成的绿色燃料电池,以石墨为电极的电池工作原理示意图,b电极为____________极(填“正”或“负”),写出该电池工作时a电极的电极反应式___________________________________________.
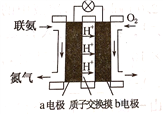
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】伪麻黄碱(D)是新康泰克的成分之一,能够缓解感冒时带来的鼻塞、流鼻涕和打喷嚏等症状,其中一种合成路线如下:
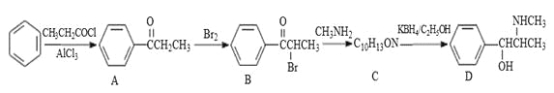
回答下列问题:
(1)伪麻黄碱(D)的分子式为 ;B中含有的官能团有 (写名称)。
(2)写出 B—C反应的化学方程式: 。C—D的反应类型为 。
(3)B的消去产物可以用于合成高分子化合物E,请写出 E的结构简式: 。
(4)满足下列要求的A的同分异构体有 种;
①能发生银镜反应
②苯环上的一氯代物有两种结构,其中核磁共振氢谱为4组峰,且峰面积之比为6:2:1:1的为 (写结构简式)。
(5)已知:![]() 。参照上述合成路线,设计一条由苯和乙酸为起始原料制备
。参照上述合成路线,设计一条由苯和乙酸为起始原料制备![]() 的合成路线: 。
的合成路线: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,其中Y、W处于同一主族,Y、Z的原子最外层电子数之和等于9,X 的简单氢化物与W的单质组成的混合气体见光可生成W的氢化物和油状混合物。下列说法正确的是
A. 简单离子半径:Y>W>Z
B. W 的氧化物对应的水化物的酸性一定比X 的强
C. Y的简单气态氢化物的热稳定性一定比W的强
D. Y 分别与X、Z形成的化合物,其所含化学键的类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应:CO(g)+H2O(g)CO2(g)+H2(g)△H<0,在850℃时,平衡常数K=1.现在850℃时,向2L的密闭容器中充入CO、H2O(g)各4mol,试回答下列问题(写出具体的计算过程):
(1)达平衡时,CO转化率为多少?
(2)H2的体积分数为多少?
(3)若温度仍为850℃,初始时CO浓度为2mol/L,H2O(g)为6mol/L,则平衡时CO转化率为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】防治禽流感病毐目前人类面临的-个重大课题。八角茴香属于草本植物,是我国民间常用做烹调的香料。医学研究成果显示,从八角茴香中可提取到莽草酸. 莽草酸有抗炎, 镇痛作用,也是合成对禽流感病爯毒有一定抑制作用的—种药物“达菲”的前体。莽草酸的结构式如下图所示,下列关于莽草酸的说法正确的是

A. 莽草酸的分子式为C7H4O5
B. 莽草酸的分子之间可能发生酯化反应
C. 莽草酸中含有苯环
D. 莽草酸不能使溴水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿素是治疗疟疾的有效药物。用水提取青蒿索需采用较高温度,产品药效较差,改用低温、乙醚冷浸,药效显著提高。若把青蒿素制成双氢青蒿素,其治疗疟疾的效果比青蒿素更好。下列叙述中正确的是
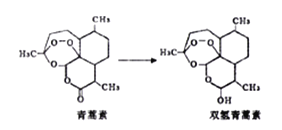
A. 青蒿素的分子式为C15H21O5 B. 双氢青蒿素的水溶性小于青蒿素
C. 青蒿素生成双氢青蒿素属于氧化反应 D. 低温可以减少药物提取过程中过氧键的断裂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com