
����Ŀ��̼��������Ԫ�ؼ��仯���������������������������ء�
I��̼�Ļ������ת���������������о�����Ҫ��Ӧ�á��ر���CO2�ĵ�̼ת�ͶԵ�������仯������Ҫ���塣

�������ݻ���Ϊ1L���ܱ��������Բ�ͬ����̼��n(H2)/n(CO2)����H2��CO2����һ�������·�����Ӧ��
2CO2(g) + 6H2(g) ![]() C2H4(g) + 4H2O(g) ��H��CO2��ƽ��ת�������¶ȵĹ�ϵ��ͼ��ʾ���١��ڡ�2.0�ֱ����������̼��ʱ�ı仯����)��
C2H4(g) + 4H2O(g) ��H��CO2��ƽ��ת�������¶ȵĹ�ϵ��ͼ��ʾ���١��ڡ�2.0�ֱ����������̼��ʱ�ı仯����)��
��ش��������⣺
��1����Ӧ�ġ�H_____0����̼����________�ڣ�Q��v(��)_____v(��)(����ڡ���С�ڡ�)
��2������ʼʱ��CO2��Ũ��Ϊ0.5mol/L��������Ũ��Ϊ1.0mol/L����P���Ӧ�¶ȵ�ƽ�ⳣ����ֵΪ_____________________��
II���ȵĻ�����ϳɡ�ת��һֱ�ǿ�ѧ�о����ȵ㡣
��һ�������£������백����Ӧ�����Ʊ��Ȱ�[NH2Cl(g)]����֪���ֻ�ѧ���ļ��ܣ�
��������Ӧ���Ȼ�ѧ����ʽΪ_______________________________________________________��
��ѧ�� | N��H | Cl��Cl | N��Cl | H��Cl |
����/kJ��mol-1 | 391.3 | 243.0 | 191.2 | 431.8 |
���Ȱ���һ�ֳ�Ч���ͺ������������л������־õ�ɱ�����ã�����ɱ��H7N9�����в�����������ԭ��Ϊ��ˮ������Ӧ����ǿ�����Ե����ʣ��÷�Ӧ�Ļ�ѧ����ʽΪ
_________________________________________________________��
III���ð�ˮ��ȥSO2
(1)��֪25��ʱ��NH3��H2O��Kb=1.8��10-5��H2SO3��Ka1=1.3��10-2��Ka2=6.2��10-8.����ˮ��Ũ��Ϊ2.0mol/L������Һ�е�c(OH-)=_________mol/L.��SO2ͨ��ð�ˮ�У���c(OH-)����1.0��10-7mol/Lʱ����Һ�е�c(SO32-)/c(HSO3-)=_____________.
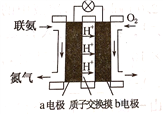
(2)���ð������������������ȡ����N2H4.��ͼ���ɡ�����-�������γɵ���ɫȼ�ϵ��,��ʯīΪ�缫�ĵ�ع���ԭ��ʾ��ͼ,b�缫Ϊ____________��(���������),д���õ�ع���ʱa�缫�ĵ缫��Ӧʽ___________________________________________.
���𰸡� С�� ���� ���� 512L3/mol3 NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g) ��H=+11.3kJ/mol NH2Cl+H2O![]() NH3+HClO��NH2Cl+2H2O
NH3+HClO��NH2Cl+2H2O![]() NH3��H2O+HClO 6.0��10-3 0.62 �� N2H4-4e-=N2+4H+
NH3��H2O+HClO 6.0��10-3 0.62 �� N2H4-4e-=N2+4H+
��������������Ҫ���黯ѧ��Ӧԭ���ۺ����⡣
I����1��CO2��ƽ��ת���������¶����߶���С����������ƽ�����ƣ���Ӧ�ġ�HС��0������ͬ�¶��£�CO2��ƽ��ת��������������������̼���������ڣ���һ���¶�����Q��ﵽƽ������У�CO2��ת������������v(��)����v(��)��
��2��ƽ��ʱ��CO2��Ũ��Ϊ0.25mol/L��������Ũ��Ϊ0.25mol/L����ϩ��Ũ��Ϊ0.125mol/L��ˮ������Ũ��Ϊ0.5mol/L����P���Ӧ�¶ȵ�ƽ�ⳣ��Ϊ =512L3/mol3��
=512L3/mol3��
II������H=��Ӧ�����֮��-���������֮��=(3��391.3+243.0-191.2-2��391.3-431.8)kJ/mol=+11.3kJ/mol����������Ӧ���Ȼ�ѧ����ʽΪNH3(g)+Cl2(g)=NH2Cl(g)+HCl(g) ��H=+11.3kJ/mol��
���Ȱ���ˮ������Ӧ���ɵ�ǿ�����������Ǵ����ᣬ�÷�Ӧ�Ļ�ѧ����ʽΪNH2Cl+2H2O![]() NH3��H2O+HClO��
NH3��H2O+HClO��
III��(1)Kb= =1.8��10-5��c(NH3��H2O)=2.0mol/L����c(OH-)��c(NH4+)=
=1.8��10-5��c(NH3��H2O)=2.0mol/L����c(OH-)��c(NH4+)=![]() =6.0��10-3mol/L. Ka2��
=6.0��10-3mol/L. Ka2�� =6.2��10-8��c(H+)=c(OH-)=1.0��10-7mol/L����Һ�е�c(SO32-)/c(HSO3-)=Ka2/ c(H+)=0.62.
=6.2��10-8��c(H+)=c(OH-)=1.0��10-7mol/L����Һ�е�c(SO32-)/c(HSO3-)=Ka2/ c(H+)=0.62.
(2) O2��b�缫����ԭ������b�缫Ϊ�������õ�ع���ʱa�缫�ĵ缫��Ӧʽ��N2H4-4e-=N2+4H+.



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ҩ��Z����������������ϵͳ�Ժ���Ǵ��ȣ�����X�������ᣩ��Y��1��4������ͪ���Ҷ�����ͪ��Ϊԭ�Ϻϳɣ���ͼ��������˵������ȷ���ǣ�������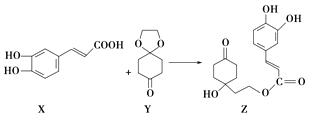
A.X�ķ���ʽΪC9H8O4
B.Y��Z�о���1������̼ԭ��
C.Z�ܷ����ӳɷ�Ӧ��ȡ����Ӧ����ȥ��Ӧ
D.1 mol Z�������3 mol Br2����ȡ����Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ��Ŵ���ͭ�����վ�տ���кܸߵ�������ֵ����ʷ��ֵ������������ͭ������ܵ�������ʴ���ʶ���������ͷ���������Ҫ���塣�о����֣���ͭ���ڳ�ʪ�����з����绯ѧ��ʴ��ԭ��ʾ��ͼ���£�����˵����ȷ����

A. ��ʴ�����У���ͭ����������
B. CuCl�ڸ�ʴ�����н����˷�Ӧ���ʱ�
C. ������4.29 g Cu2��OH��3Cl���������Ϻ������Ϊ0.448L
D. ����״Ag2OͿ�ڱ���ʴ��λ�����Է�ֹ��ͭ����һ������ʴ��Ag2O����㷢�����ֽⷴӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1828�꣬�¹���ѧ�Ҹ������ϣ��ά���״�ʹ��(NH4)2SO4�������KCNO�˹��ϳ�������CO(NH2)2���������л��������"������"ѧ˵��
��1�� (NH4)2SO4��KCNO�ϳ����ط�Ӧ�Ļ�ѧ����ʽΪ____________��
��2��ijС��ͬѧ��ʵ���������£�����CO2��NH3���ڴ����������ºϳ�������
����CO2��NH3�ϳ����� CO(NH2)2��Ӧ�Ļ�ѧ����ʽΪ____________��
��ʵ�������CO2���ö���װ�����Ʊ���Ҫ��ﵽ���濪���á������ͣ����Ŀ�ģ�����װ��A��B��C��D��E�з���Ҫ�����____________������ĸ����
������Fװ���ռ�������������Ӧ�ɵ��ܿ�____________������a������b�������롣




��3��������Ʒ�е����������ü�ȩ���궨����ԭ�����£�������Ũ����ֽ�������ʹ��Һ�еİ���������鱗��ų�������̼���������������кͺ�õ�������Σ����ü�ȩ��HCHO��������������������μ����������(CH2)6N4H+���������ñ�����������Һ�ζ���
�ټ�ȩ������立�Ӧ�����ӷ���ʽΪ____________��
�ڵζ�ѡ�õ�ָʾ��Ϊ____________���ζ��յ������Ϊ____________��
������ȡ��Ʒm g���ܽ�����250mL��Һ��ȡ25.00mL��Ʒ��Һ��250 mL��ƿ�У�����10mL w%�ļ�ȩ��Һ����ַ�Ӧ����1��2��ָʾ������Ũ��Ϊa mol/L��NaOH����Һ�ζ����յ㣨��֪�ζ�ʱ��1 mol���μ����������(CH2)6N4H+����OH����������1mol H+�൱�����ظ�2�Σ�����NaOH����Һ�����ƽ��ֵΪb mL�������Ʒ�е�����������Ϊ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������18��Ԫ�أ�����ػ������ڻ�����ҽҩ�����ϵ���������Ź㷺��Ӧ�á���ش��������⣺
��1����̬��ԭ�Ӻ����������״Ϊ____________������ռ�ݵ�����ܲ������____________��
��2��������������V2O5�������Ṥҵ����Ҫ�Ĵ�������̬��ԭ�ӵļ۵����Ų�ʽΪ____________��
��3������������Ƭ������ȱ����ƶѪ��Ԥ�������Ƶij���ҩ��������������ǹؼ��ɷ֣�K3[Fe(CN)6]��Һ�Ǽ���Fe2+���Լ���1molCN-�к���������ĿΪ____________���ٴ��������ά����C�ٽ��������������գ���������Fe3+���ӽṹ�Ƕ�������Fe2+�ױ�������Fe3+��ԭ����____________��
��4���ء��ࡢ�顢���ĵ�һ�������ɴ�С��˳��Ϊ____________����Ԫ�ط��ű�ʾ����������Ļ��������Ȼ�����������ά���Ӽ������۵�Ϊ-49.5�����е�Ϊ83.1�������侧������Ϊ____________������ԭ�ӵ��ӻ�����Ϊ____________�����������������ᣬ�ӷ��ӽṹ�ĽǶȽ���ԭ��____________���黯����һ�����Ͳ��������Ϊ��õ��ȵ�������ṹ����ʯ��������֪�黯������Ϊbpm����þ�����ܶ�Ϊ____________ g ��cm-3��(NA��ʾ�����ӵ�������ֵ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ���ǣ� ��
A.�ǽ���Ԫ��֮�乹�ɵĻ����ﶼ�������ӻ�����
B.����������ͨ�������������γɵĻ�ѧ�������Ӽ�
C.���ӻ�������һ��û�й��ۼ�
D.���������ӵĻ�����һ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��������ܱ������У��������»�ѧ��Ӧ��CO2��g��+H2��g��CO��g��+H2O��g�����仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
t�� | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
�ش��������⣺
��1���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪ��
��2����Ӧ����Ӧ����ѡ����ȡ������ȣ���
��3�����жϸ÷�Ӧ�Ƿ�ﵽ��ѧƽ��״̬�������� ��
a��������ѹǿ���� b�����������c��CO������
c��v����H2��=v����H2O�� d��c��CO2��=c��CO��
��4��ij�¶��£�ƽ��Ũ�ȷ�����ʽ��c��CO2��c��CH2��=c��CO��c��H2O�������жϴ�ʱ���¶�Ϊ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ����٤��������ֵ�������ж���ȷ���ǣ�������
A.32��O2��O3��ɵĻ�������к��е���ԭ����ĿΪ2NA
B.���³�ѹ�£�22.4 L�Ҵ����еķ�����ĿΪNA
C.1 mol Na��ΪNa+ʱ�õ��ĵ�����ĿΪNA
D.44��14C16O2����ԭ����Ϊ2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ұ��ҵ�ϣ���������ͨ����ѧ��ԭ���ƵõĽ�������( )
A.Na��Mg ��AlB.Na��K ��Zn
C.Fe��Cu��AgD.Na��Ca��K
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com