
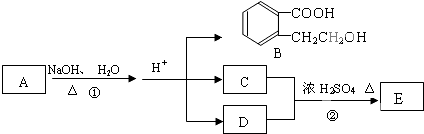
| 102×58.8% |
| 12 |
| 102×9.8% |
| 1 |
| 102-12×5-10 |
| 16 |
 ,据此解答.
,据此解答.| 102×58.8% |
| 12 |
| 102×9.8% |
| 1 |
| 102-12×5-10 |
| 16 |
 ,
,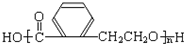 ,故答案为:
,故答案为: ;
;| 水 |
| △ |
| 水 |
| △ |
 ,故答案为:
,故答案为: ;
;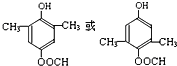 ,
,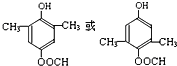 .
.


科目:高中化学 来源: 题型:
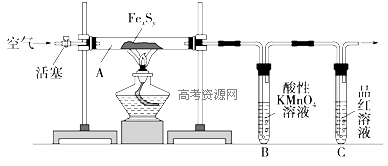
| 滴定次数 | 待测溶液 体积/mL | 草酸溶液体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.50 | 23.70 |
| 2 | 25.00 | 1.02 | 26.03 |
| 3 | 25.00 | 0.00 | 24.99 |
- 4 |
2- 4 |
- 4 |
| 编号 | 温度/℃ | 酸化的H2C2O4溶液/mL | KMnO4溶液/mL | 溶液褪色时间/s |
| 1 | 25 | 5.0 | 2.0 | 40 |
| 2 | 25 | 5.0(另加少量可溶于水的MnSO4粉末) | 2.0 | 4 |
| 3 | 60 | 5.0 | 2.0 | 25 |
查看答案和解析>>
科目:高中化学 来源: 题型:
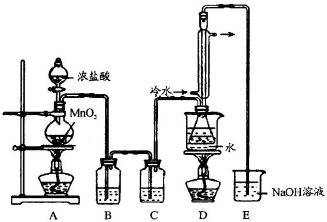
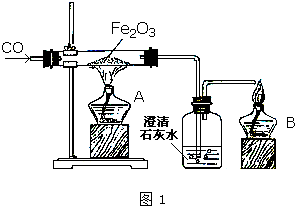 某研究性学习小组在用右图装置进行CO还原Fe2O3的探究实验.
某研究性学习小组在用右图装置进行CO还原Fe2O3的探究实验.| 实验编号 | 实 验 操 作 | 实 验 现 象 |
| ① | 取少量黑色粉末X放入试管1中,注入适量稀盐酸,微热. | 黑色粉末逐渐溶解, 有无色气体逸出. |
| ② | 向试管1所得溶液中滴加几滴 KSCN溶液,振荡. | 溶液未出现血红色 |
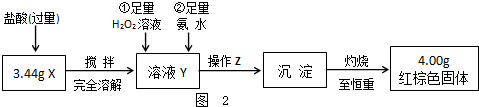
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,下列说法中正确的是( )
,下列说法中正确的是( )| A、D元素的负化合价为-2价时,E元素的最高化合价一定为+7 |
| B、B(OH)m为强碱时,A(OH)n也一定为强碱 |
| C、HnDOm为强酸时,E的非金属性一定很强 |
| D、HnCOm为强酸时,E的单质可能有强还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
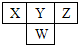 如图是元素周期表中短周期的一部分.已知Y和W原子能形成两种造成酸雨的有害气体,则下列说法不正确的是( )
如图是元素周期表中短周期的一部分.已知Y和W原子能形成两种造成酸雨的有害气体,则下列说法不正确的是( )| A、原子半径:W>Y>Z |
| B、X的氢化物不如Z的氢化物稳定 |
| C、Y的氢化物比W的氢化物沸点高,是因为存在氢键 |
| D、常见的X的氢化物具有正四面体结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 是工业上常用的硫化剂,实验室制备的方法有2种:
是工业上常用的硫化剂,实验室制备的方法有2种:| 111-140℃ |
| 95-100℃ |
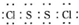 ,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低).反应涉及的几种物质的熔沸点如下:
,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低).反应涉及的几种物质的熔沸点如下:| 物质 | S | SC2 | CCl4 | S2Cl2 |
| 沸点/℃ | 445 | 47 | 77 | 137 |
| 熔点/℃ | 113 | -109 | -23 | -77 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 现象 | 离子方程式 | |
| KCl | ||
| NaAlO2 | ||
| Na2CO3 | ||
| Na2S | ||
| Na2SiO3 | ||
| Na2S2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com