
 ,下列说法中正确的是( )
,下列说法中正确的是( )| A、D元素的负化合价为-2价时,E元素的最高化合价一定为+7 |
| B、B(OH)m为强碱时,A(OH)n也一定为强碱 |
| C、HnDOm为强酸时,E的非金属性一定很强 |
| D、HnCOm为强酸时,E的单质可能有强还原性 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、Cl- |
| B、SO42- |
| C、Ca2+ |
| D、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
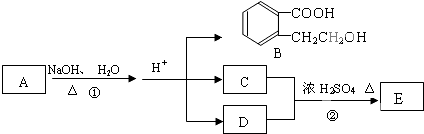
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③ | B、③ |
| C、①②③④ | D、①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/℃ | 700 | 800 | 900 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.3 | 1.8 | 2.7 |
| A、该反应正反应为放热反应 |
| B、K越大,反应物的转化率越大 |
| C、温度不变,增加X的用量,K增大 |
| D、达平衡后,加入催化剂,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com