
| A、在中性的溶液中:Ag+、K+、SO42-、Cl- |
| B、pH=12的溶液中:Na+、S2-、AlO2-、SO32- |
| C、有CO32-存在的溶液中:Na+、Fe3+、Ca2+、I- |
| D、在加入铝粉能产生H2的溶液中:NH4+、Fe2+、SO42-、NO3- |


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
| A、1L 0.1mol/L(NH4)2Fe(SO4)2的溶液:c(SO42-)>c(NH4+)>c(Fe2+)>c(OH-)>c(H+) |
| B、在Na2CO3和NaHCO3的混合溶液中:c(Na+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-) |
| C、常温下,CH3COONa溶液和盐酸混合所得中性溶液:c(Na+)>c(Cl-)=c(CH3COOH) |
| D、25℃时,pH=4.5的NaHC2O4溶液:c(HC2O4-)>c(C2O42-)>c(H2C2O4) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| NaOH溶液 |
| △ |
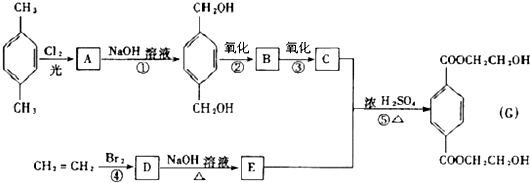
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有②③ | B、只有①② |
| C、只有①③ | D、①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| A | 所有单质中密度最小 |
| B | 形成化合物种类最多的元素 |
| D | 基态原子中只有3个能级,有2个未成对电子 |
| E | 短周期中原子半径最大 |
| F | 第三周期中电负性最大的元素 |
| G | 最外层只有一个电子,内层填满电子 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
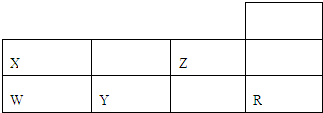 下表是元素周期表前三周期的一部分,按要求作答:
下表是元素周期表前三周期的一部分,按要求作答:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol H2O的质量为18g/mol |
| B、3.01×1023个SO2分子的质量为32g |
| C、氧的摩尔质量为16g/mol |
| D、标准状况下,1 mol任何物质体积均为22.4L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com