
【题目】氮化钠(Na3N)固体是一种重要的化合物,它与水反应可产生NH3。回答下列问题:
(1)Na3N属于________(填“共价”或“离子”)化合物,Na3N的电子式为________。
(2)Na3N与足量盐酸反应的化学方程式为________。
(3)比较Na3N中两种粒子的半径:r(Na+)________r(N3-)(填“>”“=”或“<”)。
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.乙酸与碳酸钠溶液反应:2H++CO32-== CO2↑+H2O
B.澄清石灰水中加入过量的碳酸氢钠溶液:Ca2+ + HCO + OH-= CaCO3↓ + H2O
C.苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O ![]() 2C6H5OH+CO32-
2C6H5OH+CO32-
D.甲醛溶液与足量的银氨溶液共热HCHO+4[Ag(NH3)2]++4OH-![]() CO32-+2NH4++ 4Ag↓+ 6NH3↑+ 2H2O 。
CO32-+2NH4++ 4Ag↓+ 6NH3↑+ 2H2O 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】O2、CH4和CO的混合气体在标准状况下的密度为1.25g/L,这三种气体的物质的量之比不可能为( )
A. 3:1:2 B. 6:2:3 C. 3:4:6 D. 9:3:7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 可用酸性高锰酸钾溶液检验丙烯醛中是否含有碳碳双键
B. 分子式为CH4O和C2H6O的物质一定互为同系物
C. 乙烯和苯都能与溴水发生反应而使其褪色
D. 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性锌锰电池是日常生活中消耗量最大的电池,其构造如图所示。
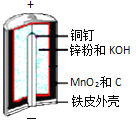
放电时总反应为:Zn + 2H2O + 2MnO2![]() Zn(OH)2 + 2MnOOH
Zn(OH)2 + 2MnOOH
从废旧碱性锌锰电池中回收Zn和MnO2的工艺如下:
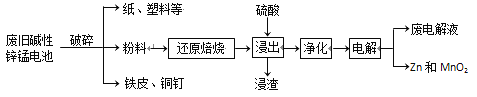
回答下列问题:
(1)MnOOH中,Mn元素的化合价为________。
(2)“还原焙烧”过程中,高价金属化合物被还原为低价氧化物或金属单质(其中MnOOH、MnO2被还原成MnO),主要原因是“粉料”中含有________。
(3)“净化”是为了除去浸出液中的Fe2+,方法是:加入________(填化学式)溶液将Fe2+氧化为Fe3+,再调节pH使Fe3+完全沉淀。(离子浓度小于1×10-5mol·L-1即为沉淀完全)已知浸出液中Mn2+、Zn2+的浓度约为0.1 mol·L-1,根据下列数据计算调节pH的合
理范围是________至________。
化合物 | Mn(OH)2 | Zn(OH)2 | Fe(OH)3 |
KSP近似值 | 10-13 | 10-17 | 10-38 |
(4)“电解”时,阳极的电极反应式为_____。本工艺中应循环利用的物质是_____(填化学式)。
(5)若将“粉料”直接与盐酸共热反应后过滤,滤液的主要成分是ZnCl2和MnCl2。“粉料”中的MnOOH与盐酸反应的化学方程式为________。
(6)某碱性锌锰电池维持电流强度0.5A(相当于每秒通过5×10-6 mol电子),连续工作80分钟即接近失效。如果制造一节电池所需的锌粉为6 g,则电池失效时仍有________%的金属锌未参加反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C4H10O的有机化合物A。按要求完成下列问题:(每空1分,共5分)
(1)若A能在催化剂作用下连续氧化生成羧酸,请写出它可能的结构简式为 、 。
(2)当C原子与4个不同的原子或基团相连时该碳原子称作“手性”碳原子。则分子式为C4H10O的有机化合物中,含有“手性”碳原子的结构简式为________________。
(3)A(C4H10O)![]() B(C4H8),已知:A分子中有三个甲基。A与浓HBr溶液一起共热生成H
B(C4H8),已知:A分子中有三个甲基。A与浓HBr溶液一起共热生成H
写出A、H的结构简式 、
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活、社会发展等息息相关。下列说法正确的是( )
A. 做衣服的棉、麻、丝绸灼烧有烧焦羽毛的气味
B. 糖尿病人应少吃含糖类的食品,可常喝糯米八宝粥
C. 现代工业生产中的芳香烃来源于石油的催化重整和煤的干馏
D. 豆浆中富含大豆蛋白,煮沸后蛋白质即水解生成氨基酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在MgCl2、KCl、K2SO4三种盐的混合溶液中,若K+、Cl-各为1.5mol,Mg2+为0.5mol,则SO42-的物质的量为 ( )
A. 0.1mol B. 0.5mol C. 0.15mol D. 0.25mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应类型中可以吸收能量的反应是
①化合反应 ②分解反应 ③置换反应 ④复分解反应 ⑤氧化还原反应
A. ①②③④⑤B. ②④C. ①③④⑤D. ②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com