
 CH3OH ( g ) ��H=-116kJ/mol
CH3OH ( g ) ��H=-116kJ/mol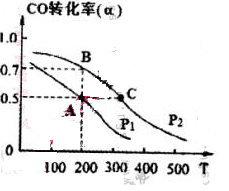

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
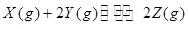 ����
����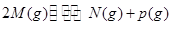 �ֱ����ܱ�������������Ӧ���н��У���Ӧ��֮������Ħ�����ɻ������ܱո��塣��Ӧ��ʼ�ʹﵽƽ��״̬ʱ�й��������ı仯��ͼ��ʾ��
�ֱ����ܱ�������������Ӧ���н��У���Ӧ��֮������Ħ�����ɻ������ܱո��塣��Ӧ��ʼ�ʹﵽƽ��״̬ʱ�й��������ı仯��ͼ��ʾ��
| A����Ӧ�ٵ�����Ӧ�����ȷ�Ӧ |
| B����ƽ�⣨I����ƽ�⣨II���е�����Ħ�������ͬ |
| C����ƽ�⣨I��ʱX���������Ϊ5/11 |
| D����ƽ�⣨I��ʱ��ϵ��ѹǿ�뷴Ӧ��ʼʱ��ϵ��ѹǿ֮��Ϊ10:11 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CO(g)��H2O(g) ��H=Q����ѧƽ�ⳣ��K���¶�T�Ĺ�ϵ���±���
CO(g)��H2O(g) ��H=Q����ѧƽ�ⳣ��K���¶�T�Ĺ�ϵ���±���| T/�� | 700 | 800 | 850 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 cC(g)��dD(g)����Ӧ�ﵽƽ����������ѹ����ԭ����һ�룬���ٴδﵽƽ��ʱ��C��Ũ��Ϊԭƽ���1.6��������������ȷ����
cC(g)��dD(g)����Ӧ�ﵽƽ����������ѹ����ԭ����һ�룬���ٴδﵽƽ��ʱ��C��Ũ��Ϊԭƽ���1.6��������������ȷ����| A��A��ת���ʱ�� | B��ƽ��������Ӧ�����ƶ� |
| C��D������������� | D��a��c��d |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 CO(g)��H2(g) ����H >0�������й�˵����ȷ����
CO(g)��H2(g) ����H >0�������й�˵����ȷ���� A��ƽ�ⳣ������ʽΪK��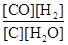 |
| B��������ϵѹǿ��ƽ�ⳣ��K�������仯 |
| C��������ϵ�¶ȣ�ƽ�ⳣ��K��С |
| D������C(s)������ƽ�������ƶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2AB3(g)��ѧƽ��״̬��Ӱ�죬�õ�����ͼ��ʾ�ı仯���ɣ�T��ʾ�¶ȣ������н�����ȷ����
2AB3(g)��ѧƽ��״̬��Ӱ�죬�õ�����ͼ��ʾ�ı仯���ɣ�T��ʾ�¶ȣ������н�����ȷ����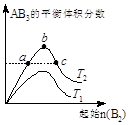
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2Z��Ӧ�ﵽƽ�⣬�������¶Ȼ��Сѹǿ������£�ƽ��������ƶ����������йط�Ӧ�ĸ�����������ȷ����
2Z��Ӧ�ﵽƽ�⣬�������¶Ȼ��Сѹǿ������£�ƽ��������ƶ����������йط�Ӧ�ĸ�����������ȷ���� | A������Ӧ�����ȷ�Ӧ��Z�ǹ��� |
| B���淴Ӧ�Ƿ��ȷ�Ӧ��Y�ǹ��壬ZΪ���� |
| C������Ӧ�����ȷ�Ӧ��ֻ��Z�������� |
| D������Ӧ�Ƿ��ȷ�Ӧ��Y��Z��Ϊ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
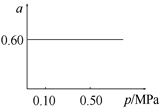
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2NH3��ƽ�ⳣ��K=a,����¶��£�NH3
2NH3��ƽ�ⳣ��K=a,����¶��£�NH3
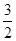 H2+
H2+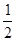 N2��ƽ�ⳣ��Ϊ�� ��
N2��ƽ�ⳣ��Ϊ�� ��| A��a-1/2 | B��a1/2 | C��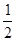 a a | D��a-2 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com