
【题目】海水是巨大的资源宝库,人类可以从海水中提取各种化工产品。下图是某工厂对海水综合利用的示意图:
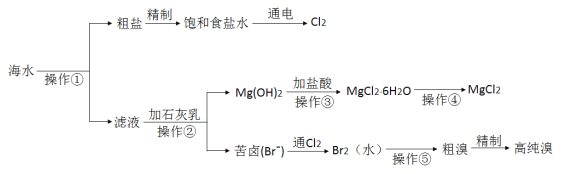
完成下列填空:
(1)写出电解饱和食盐水的化学方程式_____________,检验氯气生成的方法是_________。
(2)液氯储存在钢瓶中,钢瓶上应贴的标签为_________________(选填编号)。
a.自燃品 b.爆炸品 c.有毒品 d.易燃品
(3)Mg(OH)2加入盐酸充分反应后,操作③ 是从MgCl2溶液中获得MgCl26H2O晶体,此处需要进行的实验操作依次为____________________________。
(4)操作④是加热MgCl26H2O获得MgCl2,简述其实验操作及其原因________________。
(5)操作⑤是向溶液中鼓入__________,即可将溴单质从溶液中分离出来,此方法的成功应用是基于溴单质有____________性。
(6)粗溴的精制过程是先将粗溴用SO2水溶液吸收,将其转变成Br,再通Cl2,最后蒸馏得到高纯溴。用SO2水溶液吸收Br2的吸收率可达95%,有关反应的离子方程式为_________。由此反应可知,除环境保护外,在工业生产中应解决的主要问题是________________________。
【答案】![]() 用湿润的淀粉KI试纸,如果试纸变蓝,说明有氯气生成 C 加热浓缩、冷却结晶、过滤、洗涤、干燥 边加热边通入干燥的HCl气体,防止MgCl2水解,同时带走水蒸气 热空气或水蒸气 挥发性 SO2+Br2+2H2O=4H++2Br-+SO42- 强酸对设备的严重腐蚀问题
用湿润的淀粉KI试纸,如果试纸变蓝,说明有氯气生成 C 加热浓缩、冷却结晶、过滤、洗涤、干燥 边加热边通入干燥的HCl气体,防止MgCl2水解,同时带走水蒸气 热空气或水蒸气 挥发性 SO2+Br2+2H2O=4H++2Br-+SO42- 强酸对设备的严重腐蚀问题
【解析】
海水晒盐后过滤分离出滤液和粗盐,①为过滤,粗盐经精制得到较为纯净的氯化钠,电解饱和食盐水可用于制备氢氧化钠、氯气和氢气,滤液加入石灰乳沉淀镁离子后操作②为过滤,在滤液中通入Cl2是将滤液中的Br-氧化为Br2,再利用热的空气将Br2吹出,操作⑤中利用SO2吸收发生SO2+Br2+2H2O=4H++2Br-+SO42-;再通入Cl2将Br-氧化为Br2,两次Br-→Br2转化的目的是对溴元素进行富集;氢氧化镁加入盐酸溶解得到氯化镁溶液,氯化镁溶液中得到氯化镁晶体,操作③是加热蒸发、冷却结晶得到无水氯化镁,操作④为电解熔融氯化镁得到金属镁,以此解答该题。
:(1)电解饱和食盐水的化学方程式为![]() ,检验氯气生成的方法是用湿润的淀粉KI试纸,如果试纸变蓝,说明有氯气生成,
,检验氯气生成的方法是用湿润的淀粉KI试纸,如果试纸变蓝,说明有氯气生成,
故答案为:![]() ;用湿润的淀粉KI试纸,如果试纸变蓝,说明有氯气生成;
;用湿润的淀粉KI试纸,如果试纸变蓝,说明有氯气生成;
(2)液氯有毒,储存在钢瓶中,钢瓶上应贴的标签为c,
故答案为:c;
(3)Mg(OH)2加入盐酸充分反应后,操作③是从MgCl2溶液中获得MgCl26H2O晶体,此处需要进行的实验操作依次为加热浓缩、冷却结晶、过滤、洗涤、干燥,
故答案为:加热浓缩、冷却结晶、过滤、洗涤、干燥;
(4)操作④是加热MgCl26H2O获得MgCl2,简述其实验操作及其原因为边加热边通入干燥的HCl气体,防止MgCl2水解,同时带走水蒸气,
故答案为:边加热边通入干燥的HCl气体,防止MgCl2水解,同时带走水蒸气;
(5)操作⑤是向溶液中鼓入热空气或水蒸气,即可将溴单质从溶液中分离出来,此方法的成功应用是基于溴单质有挥发性,
故答案为:热空气或水蒸气;挥发;
(6)粗溴的精制过程是先将粗溴用SO2水溶液吸收,将其转变成Br-,再通Cl2,最后蒸馏得到高纯溴,用SO2水溶液吸收Br2的吸收率可达95%,有关反应的离子方程式为SO2+Br2+2H2O=4H++2Br-+SO42-,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是强酸对设备的严重腐蚀问题,
故答案为:SO2+Br2+2H2O=4H++2Br-+SO42-;强酸对设备的严重腐蚀问题。


 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
【题目】亚氯酸钠![]() 用于漂白织物、纤维、纸浆,具有对纤维损伤小的特点.其在溶液中可生成
用于漂白织物、纤维、纸浆,具有对纤维损伤小的特点.其在溶液中可生成![]() 、
、![]() 、
、![]() 、
、![]() 等,其中
等,其中![]() 和
和![]() 都具有漂白作用.已知
都具有漂白作用.已知![]() ,经测定
,经测定![]() 时各组分含量随pOH变化情况如图所示
时各组分含量随pOH变化情况如图所示![]() 没有画出
没有画出![]() ,此温度下,下列分析正确的是
,此温度下,下列分析正确的是![]()
![]()
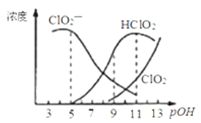
A.![]() 的电离平衡常数的数值
的电离平衡常数的数值![]()
B.亚氯酸钠在酸性条件下较稳定
C.![]() 时,溶液中含氯微粒的浓度大小为:
时,溶液中含氯微粒的浓度大小为:![]()
D.同浓度的![]() 溶液和
溶液和![]() 溶液等体积混合,则混合溶液中有
溶液等体积混合,则混合溶液中有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向![]() 溶液中逐滴加入
溶液中逐滴加入![]() 的一元酸HA,溶液的pH的变化曲线如图所示, 不正确的是
的一元酸HA,溶液的pH的变化曲线如图所示, 不正确的是
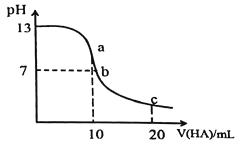
A.a点时,溶液中存在![]()
B.b点时,![]()
C.c点时,溶液中存在![]()
D.水的电离程度:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 25℃下时,NH3·H2O kb=1.77×10-5;H2CO3 ka1=4.30×10-7、ka2=5.61×10-11。 25℃时有关NH4HCO3溶液的说法中正确的是
A. 呈弱酸性
B. c(OH-)+c(NH3·H2O)=c(H+)+c(H2CO3)
C. 滴入NaOH 溶液发生反应:NH4++OH-=NH3·H2O和HCO3-+OH-=H2O+CO32-
D. 滴入NaOH溶液,则![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸钠(NaH2PO2)常用作化学镀剂、食品及工业锅炉水添加剂、抗氧剂。实验室可用如图所示装置制取一定量的次磷酸钠。已知PH3是一种无色、有毒且能自燃的气体。

回答下列问题:
(1)装烧碱溶液的仪器名称是___,已知NaH2PO2与盐酸反应但不能与NaOH溶液反应,则次磷酸(H3PO2)是___元弱酸。
(2)实验开始时,首先要打开K1,通入一段时间N2,其目的是___,为尽可能避免PH3造成的空气污染,拆卸装置前还要进行的一项操作是___,a中反应的化学方程式为___。
(3)装置C中物质反应后生成了NaCl、NaH2PO2,通过___的方法可分离出NaH2PO2固体(已知NaH2PO2在25℃时溶解度为100g,100℃时溶解度为667g)。
(4)产品纯度测定:取产品mg,将其溶于水配成250mL溶液,再用___(填“酸式”或“碱式”)滴定管取25.00mL溶液于锥形瓶中,然后用0.01mol·L-1的KMnO4标准溶液滴定(氧化产物是PO43-),达到滴定终点时消耗V1mLKMnO4标准溶液,滴定终点的现象是___,产品纯度为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属锂及其化合物用途广泛。其在“氮的固定”中转化过程如图所示:
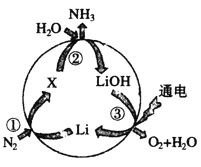
(1)图中X的化学式为__________。
(2)图中所示物质既含共价键、又含离子键的是_______(填化学式),属于电解质的有______种。
(3)③中阳极电极反应式为____________________。
(4)图中所示过程总转化关系式为_______________。
(5)Li也可用于空气中CO2的固定,其工作原理为:4Li+3CO2![]() 2Li2CO3+C。电池的电解质称为电池的“血液”,该电池的电解质应为_______________(填化学式)。正极电极反应式为_________________________________。反应中当有3mol氧化剂被还原,通过交换膜的Li+为_________mol。
2Li2CO3+C。电池的电解质称为电池的“血液”,该电池的电解质应为_______________(填化学式)。正极电极反应式为_________________________________。反应中当有3mol氧化剂被还原,通过交换膜的Li+为_________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于苯乙烯(![]() )有下列叙述:① 能使酸性KMnO4溶液褪色;② 能使溴的四氯化碳溶液褪色;③ 可溶于水;④ 可溶于苯中;⑤ 能与浓硝酸发生取代反应;⑥ 所有的原子可能共平面。其中正确的是( )
)有下列叙述:① 能使酸性KMnO4溶液褪色;② 能使溴的四氯化碳溶液褪色;③ 可溶于水;④ 可溶于苯中;⑤ 能与浓硝酸发生取代反应;⑥ 所有的原子可能共平面。其中正确的是( )
A. ①②③④⑤ B. ①②⑤⑥ C. ①②④⑤⑥ D. 全部正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器,一定条件下进行反应:mA(g)+nB(g)pC(g)+qD(g)。若增大压强或升高温度,重新达到平衡,变化过程均如图所示,则对该反应叙述正确的是( )
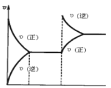
A.m+n<p+qB.逆反应是放热反应
C.m+n>p+qD.正反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中的下列做法不合理的是( )
①实验室中钠着火时,用泡沫灭火器灭火
②实验室保存氯化亚铁溶液时加入适量铁粉
③用饱和碳酸钠溶液除去二氧化碳气体中的氯化氢
④用水除去一氧化氮气体中的二氧化氮
⑤用浓硫酸干燥硫化氢气体
⑥用氢氧化钠溶液除去氧化铁中的氧化铝
A.①②③B.③④⑤C.①③⑤D.②④⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com