
ЁОЬтФПЁПЦјЬЌЬўAдкБъПіЯТЕФУмЖШЪЧ1.16gЁЄLЃ1ЃЌвЛЖЈЬѕМўЯТгыЕШЮяжЪЕФСПЕФH2ЗДгІЩњГЩBЃЌDЪЧЪГДзЕФжївЊГЩЗжЃЌEЪЧВЛвзШмгкЫЎЕФгЭзДвКЬхЃЌгаХЈгєЯуЮЖЁЃгаЙиЮяжЪЕФзЊЛЏЙиЯЕШчЯТЃК

ЧыЛиД№ЃК
(1)ABЕФЗДгІРраЭЪЧ_____________ЁЃ
(2)BЃЋDEЕФЛЏбЇЗНГЬЪНЪЧ_________________________________ЁЃ
(3)ЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ______ЁЃ
AЃЎBдквЛЖЈЬѕМўЯТФмЩњГЩИпЗжзгЛЏКЯЮя
BЃЎCЁЂDЁЂEФмгУБЅКЭЬМЫсФЦШмвКМјБ№
CЃЎЯрЭЌЮяжЪЕФСПЕФAЁЂDЭъШЋШМЩеЩњГЩЫЎЕФжЪСПЯрЕШ
DЃЎЪЕбщЪвжЦБИEЪБПЩгУХЈСђЫсзїДпЛЏМСКЭЮќЫЎМС
ЁОД№АИЁПМгГЩ/ЛЙд CH2ЃНCH2ЃЋCH3COOH![]() CH3COOCH2CH3 C
CH3COOCH2CH3 C
ЁОНтЮіЁП
ЦјЬЌЬўAдкБъПіЯТЕФУмЖШЪЧ1.16gЁЄLЃ1ЃЌдђAЕФФІЖћжЪСПЮЊ1.16gЁЄLЃ1![]() 22.4LЁЄmolЃ1=26gЁЄmolЃ1ЃЌдквЛЖЈЬѕМўЯТAгыЕШЮяжЪЕФСПЕФH2ЗДгІЩњГЩBЃЌЭЦжЊAЮЊввШВЃЌBЮЊввЯЉЃЛDЪЧЪГДзЕФжївЊГЩЗжЃЌдђDЮЊввЫсЃЛEЪЧВЛвзШмгкЫЎЕФгЭзДвКЬхЃЌгаХЈгєЯуЮЖЁЃ
22.4LЁЄmolЃ1=26gЁЄmolЃ1ЃЌдквЛЖЈЬѕМўЯТAгыЕШЮяжЪЕФСПЕФH2ЗДгІЩњГЩBЃЌЭЦжЊAЮЊввШВЃЌBЮЊввЯЉЃЛDЪЧЪГДзЕФжївЊГЩЗжЃЌдђDЮЊввЫсЃЛEЪЧВЛвзШмгкЫЎЕФгЭзДвКЬхЃЌгаХЈгєЯуЮЖЁЃ
(1)злЩЯЗжЮіЃЌAгыЧтЦјЗЂЩњМгГЩЗДгІЩњГЩBЁЃ
(2)BЮЊввЯЉЃЌDЮЊввЫсЃЌввЯЉгыввЫсЩњГЩВЛвзШмгкЫЎЕФгЭзДвКЬхЃЌгаХЈгєЯуЮЖEЃЌEЮЊввЫсввѕЅЃЌЛЏбЇЗНГЬЪНЪЧCH2ЃНCH2ЃЋCH3COOH![]() CH3COOCH2CH3ЁЃ
CH3COOCH2CH3ЁЃ
(3) AЃЎBЮЊввЯЉЃЌФмдквЛЖЈЬѕМўЯТФмЗЂЩњМгОлЗДгІЩњГЩИпЗжзгЛЏКЯЮяОлввЯЉЃЌAе§ШЗЃЛ
BЃЎCЮЊввДМЃЌФмгыБЅКЭЬМЫсФЦШмвКЛЅШмЁЂDЮЊввЫсЃЌгыЬМЫсФЦЗДгІВњЩњЦјХнЁЂEЮЊввЫсввѕЅЃЌгыБЅКЭЬМЫсФЦШмвКВЛЛЅШмЃЌЗжВуЃЌЙЪФмгУБЅКЭЬМЫсФЦШмвКМјБ№ЃЌBе§ШЗЃЛ
CЃЎAЕФЗжзгЪНЮЊC2H2ЃЌDЕФЗжзгЪНЮЊC2H4O2ЃЌ1molЕФAЁЂDЭъШЋШМЩеЩњГЩЫЎЕФЮяжЪЕФСПЮЊ1molЁЂ2molЃЌжЪСПВЛЯрЕШЃЌCДэЮѓЃЛ
DЃЎЪЕбщЪвжагУввЫсКЭввДМЗДгІжЦБИввЫсввѕЅЃЌПЩгУХЈСђЫсзїДпЛЏМСКЭЮќЫЎМСЃЌDе§ШЗЃЛ
Д№АИбЁCЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁППЇЗШвђЪЧвЛжжЩњЮяМюЃЈвзШмгкЫЎМАввДМЃЌШлЕу234.5ЁцЃЌ100ЁцвдЩЯПЊЪМЩ§ЛЊЃЉЃЌгааЫЗмДѓФдЩёОКЭРћФђЕШзїгУЁЃВшвЖжаКЌПЇЗШвђдМ1%~5%ЁЂЕЅФўЫсЃЈKaдМЮЊ104ЃЌвзШмгкЫЎМАввДМЃЉдМ3%~10%ЃЌЛЙКЌгаЩЋЫиЁЂЯЫЮЌЫиЕШЁЃЪЕбщЪвДгВшвЖжаЬсШЁПЇЗШвђЕФСїГЬШчЯТЭМЫљЪОЁЃ

ЫїЪЯЬсШЁзАжУШчЭМЫљЪОЁЃЪЕбщЪБЩеЦПжаШмМСЪмШШеєЗЂЃЌеєЦћбиеєЦћЕМЙм2ЩЯЩ§жСЧђаЮРфФ§ЙмЃЌРфФ§КѓЕЮШыТЫжНЬзЭВ1жаЃЌгыВшвЖФЉНгДЅЃЌНјаанЭШЁЁЃнЭШЁвКвКУцДяЕНКчЮќЙм3ЖЅЖЫЪБЃЌОКчЮќЙм3ЗЕЛиЩеЦПЃЌДгЖјЪЕЯжЖдВшвЖФЉЕФСЌајнЭШЁЁЃЛиД№ЯТСаЮЪЬтЃК

ЃЈ1ЃЉЪЕбщЪБашНЋВшвЖбаЯИЃЌЗХШыТЫжНЬзЭВ1жаЃЌбаЯИЕФФПЕФЪЧ______________ЃЌдВЕзЩеЦПжаМгШы95%ввДМЮЊШмМСЃЌМгШШЧАЛЙвЊМгМИСЃ______________ЁЃ
ЃЈ2ЃЉЬсШЁЙ§ГЬВЛПЩбЁгУУїЛ№жБНгМгШШЃЌдвђЪЧ______________ЃЌгыГЃЙцЕФнЭШЁЯрБШЃЌВЩгУЫїЪЯЬсШЁЦїЕФгХЕуЪЧ______________ЁЃ
ЃЈ3ЃЉЬсШЁвКашОЁАеєСѓХЈЫѕЁБГ§ШЅДѓВПЗжШмМСЃЌгыЫЎЯрБШЃЌввДМзїЮЊнЭШЁМСЕФгХЕуЪЧ______________ЁЃЁАеєСѓХЈЫѕЁБашбЁгУЕФвЧЦїГ§СЫдВЕзЩеЦПЁЂеєСѓЭЗЁЂЮТЖШМЦЁЂНгЪеЙмжЎЭтЃЌЛЙга______________ЃЈЬюБъКХЃЉЁЃ
AЃЎжБаЮРфФ§Йм BЃЎЧђаЮРфФ§ЙмCЃЎНгЪеЦПDЃЎЩеБ
ЃЈ4ЃЉХЈЫѕвКМгЩњЪЏЛвЕФзїгУЪЧжаКЭ______________КЭЮќЪе______________ЁЃ
ЃЈ5ЃЉПЩВЩгУШчЭМЫљЪОЕФМђвззАжУЗжРыЬсДППЇЗШвђЁЃНЋЗлзДЮяЗХШыеєЗЂУѓжаВЂаЁЛ№МгШШЃЌПЇЗШвђдкдњгааЁПзЕФТЫжНЩЯФ§НсЃЌИУЗжРыЬсДПЗНЗЈЕФУћГЦЪЧ______________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊXЁЂYЁЂZЁЂWЁЂM ОљЮЊЖЬжмЦкдЊЫиЁЃ25ЁцЪБЃЌЦфзюИпМлбѕЛЏЮяЖдгІЕФЫЎЛЏЮяЃЈХЈЖШОљЮЊ0.01mol/LЃЉШмвКЕФpHКЭдзгАыОЖЕФЙиЯЕШчЭМЫљЪОЁЃЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ

A. XЁЂM МђЕЅРызгАыОЖДѓаЁЫГађЃКX>M
B. XЁЂYЁЂZЁЂWЁЂM ЮхжждЊЫижажЛгавЛжжЪЧН№ЪєдЊЫи
C. Z ЕФзюИпМлбѕЛЏЮяЕФЛЏбЇЪНЮЊZO3
D. XЁЂZЕФзюМђЕЅЦјЬЌЧтЛЏЮяЗДгІЯжЯѓЃКгаАзбЬЩњГЩXY ZW
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПXЁЂYЁЂZЁЂWЁЂQЪЧдзгађЪ§вРДЮдіДѓЕФЮхжжЖЬжмЦкжїзхдЊЫиЁЃЦфжажЛгаZЪЧН№ЪєдЊЫиЃЌWЕФЕЅжЪЪЧЛЦЩЋЙЬЬхЃЌXЁЂYЁЂWдкжмЦкБэжаЕФЯрЖдЮЛжУЙиЯЕШчЭМЫљЪОЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ( )
A.ZЕФзюИпМлбѕЛЏЮяЖдгІЕФЫЎЛЏЮяВЛПЩФмЯдШѕМюад
B.YЕФМђЕЅвѕРызгБШWЕФМђЕЅвѕРызгЕФЛЙдадШѕ
C.дЊЫиZЁЂWЁЂQжадзгАыОЖзюДѓЕФЪЧQ
D.WЕФзюИпМлбѕЛЏЮяЖдгІЕФЫЎЛЏЮяХЈШмвКМгШШЪБВЛПЩФмгыЭЗДгІ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЫФЗљЭМЪОЫљБэЪОЕФаХЯЂгыЖдгІЕФа№ЪіЯрЗћЕФЪЧЃЈ ЃЉ
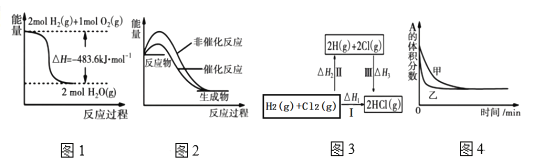
A. ЭМ1БэЪОH2гыO2ЗЂЩњЗДгІЙ§ГЬжаЕФФмСПБфЛЏЃЌдђH2ЕФШМЩеШШЮЊ241.8kJЁЄmolЁЊ1
B. ЭМ2БэЪОФГЮќШШЗДгІЗжБ№дкгаЁЂЮоДпЛЏМСЕФЧщПіЯТЗДгІЙ§ГЬжаЕФФмСПБфЛЏ
C. ЭМ3БэЪОвЛЖЈЬѕМўЯТH2КЭCl2ЩњГЩHClЕФЗДгІШШгыЭООЖЮоЙиЃЌдђ ЁїH1=ЁїH2+ЁїH3
D. ЭМ4БэЪОбЙЧПЖдПЩФцЗДгІ2A(g)+2B(g)![]() 3C(g)+D(s)ЕФгАЯьЃЌввЕФбЙЧПДѓ
3C(g)+D(s)ЕФгАЯьЃЌввЕФбЙЧПДѓ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГЪЕбщаЁзщРћгУЯТЭМЫљСазАжУНјааЁАЬњгыЫЎеєЦјЗДгІЁБЕФЪЕбщЃЌВЂРћгУВњЮяНјвЛВНжЦШЁFeCl3ЁЄ6H2OОЇЬхЃЎЃЈЭМжаМаГжМАЮВЦјДІРэзАжУОљвбТдШЅЃЉЧыЛиД№ЯТСаЮЪЬтЃК
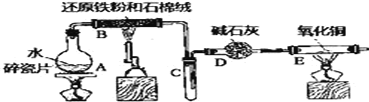
ЃЈ1ЃЉзАжУBжаЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪНЪЧ_______________________ЃЎ
ЃЈ2ЃЉDЕФзїгУЪЧ________ЁЃЕуШМEДІОЦОЋЕЦжЎЧАгІНјааЕФВйзїЪЧ_________ЁЃEжаГіЯжЕФЯжЯѓЪЧ__________ЃЎ
ЃЈ3ЃЉИУаЁзщАбBжаЗДгІКѓЕФВњЮяМгШызуСПЕФбЮЫсЃЌгУИУШмвКжЦШЁFeCl3ЁЄ6H2OОЇЬхЃЎ
ЂйгћМьбщШмвКжаКЌгаFe3+ЃЌбЁгУЕФЪдМСЮЊ____________ЃЌЯжЯѓЪЧ_____________ЃЎ
ЂкИУЪЕбщаЁзщЭЌбЇгУЩЯЪіЪдМСУЛгаМьВтЕНFe3+ЃЌгУРызгЗНГЬЪННтЪЭТЫвКжаВЛДцдкFe3+ПЩФмЕФдвђЃК_______________ЃЎ
ЂлНЋДЫТЫвКжаFeCl2ЭъШЋбѕЛЏЮЊFeCl3зюКУбЁдёЯТСаЮяжЪжаЕФ___________ЃЎ
AЃЎЫсадKMnO4ШмвК BЃЎCl2 CЃЎNa2O2 DЃЎFeCl3
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЮЊВтЖЈФГгаЛњЛЏКЯЮяAЕФНсЙЙ,НјааШчЯТЪЕбщ:
I. ЗжзгЪНЕФШЗЖЈ:
ЃЈ1ЃЉНЋгаЛњЮяAжУгкбѕЦјСїжаГфЗжШМЩе,ЪЕбщВтЕУ:ЩњГЩ5.4g H2OКЭ8.8g CO2,ЯћКФбѕЦј6.72L(БъзМзДПіЯТ),дђИУЮяжЪЕФЪЕбщЪНЪЧ__________.
ЃЈ2ЃЉгУжЪЦзвЧВтЖЈИУгаЛњЛЏКЯЮяЕФЯрЖдЗжзгжЪСП,ЕУЕНШчЭМЂйЫљЪОжЪЦзЭМ,дђЦфЯрЖдЗжзгжЪСПЮЊ__________,ИУЮяжЪЕФЗжзгЪНЪЧ__________.
ЃЈ3ЃЉИљОнМлМќРэТл,дЄВтAЕФПЩФмНсЙЙВЂаДГіНсЙЙМђЪН__________.
II.НсЙЙЪНЕФШЗЖЈ:
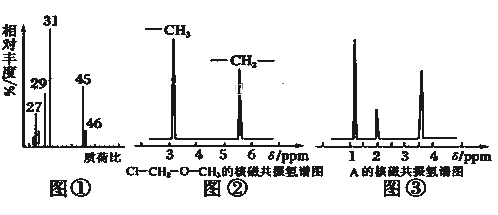
ЃЈ4ЃЉКЫДХЙВеёЧтЦзФмЖдгаЛњЮяЗжзгжаВЛЭЌЮЛжУЕФЧтдзгИјГіВЛЭЌЕФЗхжЕ(аХКХ),ИљОнЗхжЕ(аХКХ)ПЩвдШЗЖЈЗжзгжаЧтдзгЕФжжРрКЭЪ§ФП.Р§Шч:МзЛљТШМзЛљУб(ClЉCH2ЉOЉCH3)гаСНжжЧтдзгШчЭМЂк.ОВтЖЈ,гаЛњЮяAЕФКЫДХЙВеёЧтЦзЪОвтЭМШчЭМЂл,дђAЕФНсЙЙМђЪНЮЊ__________.
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПГЃЮТЯТЃЌНЋЬхЛ§ОљЮЊ1 mLЁЂХЈЖШОљЮЊ0.10 mol/LЕФXOHКЭX2CO3ШмвКЗжБ№МгЫЎЯЁЪЭжСЬхЛ§ЮЊV mLЃЌpHЫцlg VЕФБфЛЏЧщПіШчЭМЫљЪОЃЌЯТСаа№Ъіжае§ШЗЕФЪЧ
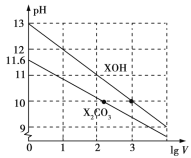
A. XOHЪЧШѕМю
B. pH=10ЕФСНжжШмвКжаЕФc(X+):XOH>X2CO3
C. вбжЊH2CO3ЕФЕчРыЦНКтГЃЪ§Ka1дЖДѓгкKa2ЃЌдђKa2дМЮЊ1.0ЁС1010.2
D. ЕБlg V=2ЪБЃЌШєX2CO3ШмвКЕФЮТЖШЩ§ИпЃЌШмвКМюаддіЧПЃЌдђ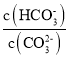 МѕаЁ
МѕаЁ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЃЈ1ЃЉЯТСаИїзщЮяжЪжаЃЌЛЅЮЊЭЌЮЛЫиЕФЪЧ__(ЬюађКХЃЌЯТЭЌ)ЃЌЛЅЮЊЭЌЯЕЮяЕФЪЧ__ЃЌЛЅЮЊЭЌЗжвьЙЙЬхЕФЪЧ__ЁЃ
ЂйКьСзгыАзСз
Ђк35Clгы37Cl
ЂлCH3COOCH3гыCH3CH2COOCH3
Ђм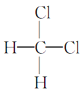 гы
гы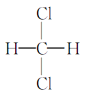
Ђн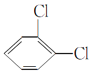 гы
гы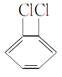
Ђо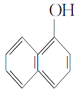 гы
гы
ЂпввДМгыЖўМзУб
ЃЈ2ЃЉAЁЋDЫФжжЮяжЪНдЮЊЬўРргаЛњЮяЃЌЗжзгЧђЙїФЃаЭЗжБ№ШчЭМЫљЪОЃЌЧыЛиД№ЯТСаЮЪЬтЁЃ

ЂйЕШЮяжЪЕФСПЕФЩЯЪіЬўЃЌЭъШЋШМЩеЪБЯћКФO2зюЖрЕФЪЧ__(ЬюзжФИДњКХЃЌЯТЭЌ)ЃЌЕШжЪСПЕФЩЯЪіЬўЭъШЋШМЩеЪБЯћКФO2зюЖрЕФЪЧ___ЁЃ
Ђкдк120ЁцЃЌ1.01ЁС105 PaЯТЃЌAКЭCЗжБ№гызуСПO2ЛьКЯЕуШМЃЌЭъШЋШМЩеКѓЦјЬхЬхЛ§УЛгаБфЛЏЕФЪЧ__ЁЃ
ЂлBЕФФГжжЭЌЯЕЮяWЃЌЗжзгЪНЮЊC6H12ЃЌЧвЫљгаЬМдзгЖМдкЭЌвЛЦНУцЩЯЃЌдђWЕФНсЙЙМђЪНЮЊ__ЁЃ
ЂмЗжзгЪНЮЊC5H12OЕФБЅКЭвЛдЊДМгаЖржжЃЌВЛФмЗЂЩњДпЛЏбѕЛЏЕФДМЗжзгНсЙЙМђЪНЃК___ЁЃ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com