
【题目】某实验小组利用下图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体.(图中夹持及尾气处理装置均已略去)请回答下列问题:
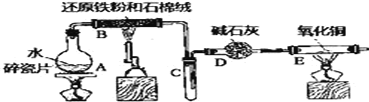
(1)装置B中发生反应的化学方程式是_______________________.
(2)D的作用是________。点燃E处酒精灯之前应进行的操作是_________。E中出现的现象是__________.
(3)该小组把B中反应后的产物加入足量的盐酸,用该溶液制取FeCl3·6H2O晶体.
①欲检验溶液中含有Fe3+,选用的试剂为____________,现象是_____________.
②该实验小组同学用上述试剂没有检测到Fe3+,用离子方程式解释滤液中不存在Fe3+可能的原因:_______________.
③将此滤液中FeCl2完全氧化为FeCl3最好选择下列物质中的___________.
A.酸性KMnO4溶液 B.Cl2 C.Na2O2 D.FeCl3
【答案】3Fe+4H2O![]() Fe3O4+4H2 吸收水分(干燥H2) 收集H2并验纯 黑色的粉末变成紫红色,管壁产生水珠 KSCN溶液 向溶液里滴加KSCN溶液,溶液变血红色 Fe+2Fe3+=3Fe2+ B
Fe3O4+4H2 吸收水分(干燥H2) 收集H2并验纯 黑色的粉末变成紫红色,管壁产生水珠 KSCN溶液 向溶液里滴加KSCN溶液,溶液变血红色 Fe+2Fe3+=3Fe2+ B
【解析】
(1)Fe与水蒸气反应生成Fe3O4和H2;
(2);碱石灰能干燥气体;装置E中红色的氧化铁被氢气还原成黑色的铁,同时有水珠生成;
(3)①Fe3+的检验方法是:取少量滤液,滴入几滴硫氰化钾溶液,观察溶液是否变红色;
②向体系中加入铁粉,如果铁粉不溶解,说明不存在Fe3+;
③滤液中FeCl2完全氧化为FeCl3,选择氧化剂能氧化亚铁离子且不引入新的杂质。
(1)装置B中为铁和水蒸气的反应,产物为四氧化三铁和氢气,对应的化学方程式为:3Fe+4H2O![]() Fe3O4+4H2;
Fe3O4+4H2;
(2)由于制备的氢气中含有水蒸气,对后续实验有干扰,因此D装置的作用为吸收水分(干燥H2);由于氢气为可燃性气体,实验前需要进行收集H2并验纯,以防止安全事故的发生;E中为氢气还原氧化铜,所以对应的实验现象为:黑色的粉末变成紫红色,管壁产生水珠;
(3)①检验铁离子一般选用KSCN溶液,其方法和现象为:向溶液里滴加KSCN溶液,溶液变血红色;
②由于金属铁可能过量,过量的金属铁能够与铁离子反应产生亚铁离子,对应的离子方程式为:Fe+2Fe3+=3Fe2+;
③将氯化亚铁转化为氯化铁,为避免引入杂质,选用的氧化剂应为氯气,即选B。


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式中,属于水解反应的是( )
A.HS- + H2O![]() H3O+ + S2-B.CO2 + 2H2O
H3O+ + S2-B.CO2 + 2H2O![]() HCO3- + H3O+
HCO3- + H3O+
C.NH4++H2O![]() NH3H2O + H+D.HCO3- + OH-
NH3H2O + H+D.HCO3- + OH-![]() CO32- + H2O
CO32- + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据环保要求,在处理有氰电镀废水时,剧毒的CN-离子在催化剂TiO2颗粒作用下,先用NaClO将CN-离子氧化成CNO-(CN-和CNO-中N元素均为-3价),再在酸性条件下继续与NaClO反应生成N2、CO2和Cl2。环保工作人员在密闭系统中用如图装置进行实验,测定CN-被处理的百分率。

现将浓缩后含CN-离子的污水与过量NaClO溶液的混合液倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。回答下列问题:
(1)根据题意,写出相关主要反应的离子方程式:甲中的反应_________________,乙中的反应:_____________________。
(2)上述实验是通过测定CO2的量来确定对CN-的处理效果。丙装置中的试剂是______________,丁装置的目的是________________________;干燥管Ⅱ的作用是______________________。
(3)假定上述每一个装置都充分吸收,则利用该装置测得的CN-被处理的百分率与实际值相比_____(填“偏高”或“偏低”),简述可能的原因:______________________。
(4)含氰废水也可采用电化学方法进行处理。在碱性条件下,使用惰性电极电解含氰废水,氰离子被氧化为无毒的物质,其中阳极电极反应式是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定Na2CO3和NaHCO3固体混合物样品的组成,称取四份质量均为2.96g的固体溶于水,分别往四份溶液中逐滴加入不同体积1.00mol·L-1的盐酸,加入盐酸溶液的体积和收集到CO2气体的体积(忽略气体在水中的溶解,气体体积均已折算成标准状况下的体积)如表所示:
实验序号 | 1 | 2 | 3 | 4 |
盐酸体积/mL | 20 | 40 | 60 | 80 |
CO2体积/mL | 0 | 448 | 672 | 672 |
下列说法不正确的是
A.实验1中发生反应的离子方程式为:CO![]() +H+=HCO
+H+=HCO![]()
B.实验2溶液中,含有NaCl、Na2CO3和NaHCO3三种溶质
C.实验3和实验4蒸干溶液所得固体一定是NaCl
D.原固体混合物中Na2CO3和NaHCO3的物质的量之比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】气态烃A在标况下的密度是1.16g·L-1,一定条件下与等物质的量的H2反应生成B,D是食醋的主要成分,E是不易溶于水的油状液体,有浓郁香味。有关物质的转化关系如下:

请回答:
(1)AB的反应类型是_____________。
(2)B+DE的化学方程式是_________________________________。
(3)下列说法不正确的是______。
A.B在一定条件下能生成高分子化合物
B.C、D、E能用饱和碳酸钠溶液鉴别
C.相同物质的量的A、D完全燃烧生成水的质量相等
D.实验室制备E时可用浓硫酸作催化剂和吸水剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 沸点:邻二甲苯>间二甲苯>对二甲苯
B. 鸡蛋淸在NH4Cl溶液中能发生盐析,但是不能和盐酸发生化学反应
C.  有机物A的分子式为C16H16O3
有机物A的分子式为C16H16O3
D.  滴入酸性KMnO4溶液振荡,紫色褪去,能证明其结构中存在碳碳双键
滴入酸性KMnO4溶液振荡,紫色褪去,能证明其结构中存在碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】500 mL AgNO3和Ca(NO3)2的混合溶液中c(NO![]() )=0.6 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24 L气体(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是( )
)=0.6 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24 L气体(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是( )
A.原混合溶液中c(Ca2+)为0.1 mol·L-1B.上述电解过程中共转移0.2 mol电子
C.电解得到的Ag的物质的量为0.1 molD.电解后溶液中c(H+)为0.2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有室温下四种溶液,有关叙述不正确的是
序号 | ① | ② | ③ | ④ |
pH | 11 | 11 | 3 | 3 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A. ③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B. ②③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C. 分别加水稀释10倍,四种溶液的pH①>②>④>③
D. V1L④与V2L①溶液混合后,若混合后溶液pH=7,则V1<V2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸甲酯是一种重要的工业原料,有机化学中通过酯化反应原理,可以进行苯甲酸甲酯的合成。有关物质的物理性质、实验装置如下所示:
苯甲酸 | 甲醇 | 苯甲酸甲酯 | |
熔点/℃ | 122.4 | ﹣97 | ﹣12.3 |
沸点/℃ | 249 | 64.3 | 199.6 |
密度/g.cm﹣3 | 1.2659 | 0.792 | 1.0888 |
水溶性 | 微溶 | 互溶 | 不溶 |
实验一:制取苯甲酸甲酯
在大试管中加入15g苯甲酸和一定量的甲醇,边振荡边缓慢加入一定量浓硫酸,按图A连接仪器并实验。

(1)苯甲酸与甲醇反应的化学方程式为______________________________________。
(2)中学实验室中制取乙酸乙酯时为了提高酯的产率可以采取的措施有___________________________
实验二:提纯苯甲酸甲酯
该实验要先利用图B装置把图A中制备的苯甲酸甲酯水洗提纯,再利用图C装置进行蒸馏提纯
(3)用图B装置进行水洗提纯时,B装置中固体Na2CO3作用是__________________。
(4)用图C装置进行蒸馏提纯时,当温度计显示____________时,可用锥形瓶收集苯甲酸甲酯。
(5)最终制取15g苯甲酸甲酯,计算得苯甲酸甲酯的产率为______________(小数点后保留1位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com