
现有四种元素的基态原子的电子排布式如下:
①1s22s22p63s23p4②1s22s22p63s23p3③1s22s22p3④1s22s22p5则下列有关比较中正确的是
A.第一电离能:④>③>②>①
B.原子半径:④>③>②>①
C.电负性:④>③>②>①
D.最高正化合价:①>③>②>④
A
【解析】
试题分析:由四种元素基态原子电子排布式可知,①1s22s22p63s23p4是S元素、②1s22s22p63s23p3是P元素、③1s22s22p3是N元素、④1s22s22p5是F元素.A、同周期自左而右第一电离能呈增大趋势,故第一电离能N<F,但P元素原子3p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,所以第一电离能S<P,同主族自上而下第一电离能降低,所以第一电离能N>P,所以第一电离能S<P<N<F,即④>③>②>①,故A正确;B、同周期自左而右原子半径减小,所以原子半径P>S,N>F,电子层越多原子半径越大,故原子半径P>S>N>F,即②>①>③>④,故B错误;
C、同周期自左而右电负性增大,所以电负性P<S,N<F,N元素非金属性与S元素强,所以电负性P<N,故电负性P<S<N<F,即②<①<③<④,故C错误;D、最高正化合价等于最外层电子数,但F元素没有正化合价,所以最高正化合价:①>②=③,故D错误.故选:A.
考点:考查结构与物质关系、核外电子排布规律、元素周期律等


科目:高中化学 来源:2014-2015学年宁夏高一上学期第一次月考化学试卷(解析版) 题型:选择题
与100 mL,2 mol/L的AlCl3溶液中Cl-的物质的量浓度相等的是( )。
A、3 mL 2 mol/L的NaCl溶液 B、50 mL 4 mol/L的FeCl3溶液
C、200 mL 1mol/L的HCl溶液 D、50 mL 3 mol/L的BaCl2溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市和平区高一上学期期中化学试卷(解析版) 题型:实验题
(12分)实验室用密度为1.18g/mL,质量分数为36.5%浓盐酸配制250mLO.lmol/L的稀盐酸溶液填空并请回答下列问题:
(1)使用容量瓶前必须进行的一步操作是______________________________;
(2)配制250mL0.lmol/L的盐稀酸溶液时,其正确的操作顺序是(字母表示,每个字母只能用一次)________________________________________;
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需浓盐酸体积__________mL,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
(3)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?若没有进行A操作浓度__________ ;若定容时俯视刻度线,浓度___________.
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市和平区高一上学期期中化学试卷(解析版) 题型:选择题
采用不同的分类方法,可将非金属氧化物分为不同的类型。例如从某种意义上可将P2O5、SO2、SO3 、Cl2O7等归为—类,则下列氧化物与它们属于同—类的是
A.CO B.NO C.N2O5 D.Na20
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川邛崃市高二上学期第一次月考化学试卷(解析版) 题型:填空题
A.B.C.D.E.F六种短周期主族元素,原子序数依次增大。其中B的单质在常温下为双原子分子,它与A可形成分子X,X的水溶液呈碱性;D的简单阳离子与X具有相同电子数,且D是同周期中简单离子半径最小的元素;基态E原子p能级上有一对成对电子,C.F两种元素的原子最外层共有13个电子。回答下列问题:
(1)D.E.F中电负性最大的是_______(填写元素符号)。
(2)写出D原子的外围电子排图为_______。
(3)B.C.E分别与A形成的化合物中沸点最高的是_______。
(4)C与D形成的化合物的化学式是_______,请写出其溶于NaOH的离子方程式_________________________;
(5)F的单质在反应中常作剂,该单质的水溶液与E的低价氧化物反应的离子方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川邛崃市高二上学期第一次月考化学试卷(解析版) 题型:选择题
某元素X的逐级电离能如下图所示,下列说法正确的是
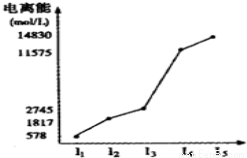
A.X元素可能为+4价
B.X为非金属
C.X为第五周期元素
D.X与氯反应时最可能生成的阳离子为X3+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川邛崃市高二上学期第一次月考化学试卷(解析版) 题型:选择题
下列说法中不正确的是()
A.共价化合物中不可能含有离子键
B.有共价键的化合物,不一定是共价化合物
C.离子化合物中可能存在共价键
D.原子以极性键结合的分子,肯定是极性分子
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省邛崃市高二上学期半期考试化学试卷(解析版) 题型:填空题
(8分)有关短周期元素A、B、C、D、E、F的信息如下:
元素 | 有关信息 |
A | 最高价氧化物对应的水化物(甲)能与其气态氢化物(乙)反应生成盐 |
B | 最外层电子数是次外层电子数的2倍 |
C | M层上有3个电子 |
D | 短周期原子半径最大的主族元素 |
E | 其单质是淡黄色固体 |
F | 最高正价与最低负价代数和为6 |
请回答下列问题:
(1)写出基态A原子外围电子的电子排布图 。气态氢化物乙中A原子的杂化类型是 。
(2)E、F两元素的电负性大小比较:E F(选填>、<或=)
(3)下列说法正确的是________(填序号)。
①实验室可用下图所示装置制取B的最高价氧化物。

②用C单质做成的槽车,都可用来运输甲的浓溶液。
③C形成的单质熔点低于D形成的单质的熔点。
④E的氢化物稳定性强于F的氢化物稳定性。
(4)将E的常见氧化物(该氧化物能使品红溶液褪色)通入由CuSO4和NaCl混合的浓 溶液中,溶液颜色变浅,析出白色沉淀,取该沉淀进行元素质量分数分析,可知其中含Cl:35.7%,Cu:64.3%,则该氧化物在上述反应中的作用是________。
A.漂白剂 B.氧化剂 C.还原剂
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高一10月月考化学试卷(解析版) 题型:选择题
下列实验操作中不正确的是
A.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
B.氢气还原氧化铜实验中先通氢气再加热实验结束时应先停止加热,继续通氢气至固体冷却
C.配制浓硫酸与蒸馏水的混合液时,应将浓硫酸慢慢加到蒸馏水中并及时搅拌和冷却
D.用胶头滴管向试管中加入液体时,为防止滴在试管外面,应将滴管尖嘴处伸入试管口中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com