
(8分)有关短周期元素A、B、C、D、E、F的信息如下:
元素 | 有关信息 |
A | 最高价氧化物对应的水化物(甲)能与其气态氢化物(乙)反应生成盐 |
B | 最外层电子数是次外层电子数的2倍 |
C | M层上有3个电子 |
D | 短周期原子半径最大的主族元素 |
E | 其单质是淡黄色固体 |
F | 最高正价与最低负价代数和为6 |
请回答下列问题:
(1)写出基态A原子外围电子的电子排布图 。气态氢化物乙中A原子的杂化类型是 。
(2)E、F两元素的电负性大小比较:E F(选填>、<或=)
(3)下列说法正确的是________(填序号)。
①实验室可用下图所示装置制取B的最高价氧化物。

②用C单质做成的槽车,都可用来运输甲的浓溶液。
③C形成的单质熔点低于D形成的单质的熔点。
④E的氢化物稳定性强于F的氢化物稳定性。
(4)将E的常见氧化物(该氧化物能使品红溶液褪色)通入由CuSO4和NaCl混合的浓 溶液中,溶液颜色变浅,析出白色沉淀,取该沉淀进行元素质量分数分析,可知其中含Cl:35.7%,Cu:64.3%,则该氧化物在上述反应中的作用是________。
A.漂白剂 B.氧化剂 C.还原剂
(8分)(除(1)题每空1分,其余每空2分)
(1)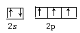 。SP3
。SP3
(2)< (
(3)①②
(4)C
【解析】
试题分析:元素的最高价氧化物的水化物与气态氢化物反应的元素是N元素,硝酸与氨气反应生成硝酸铵,所以A是N元素;最外层电子数是次外层电子数的2倍的元素的次外层不可能是8个电子,所以只能是2个电子,则该元素有2层电子,分别是2、4,所以B是C元素;C元素的M层上有3个电子,则C是Al元素;短周期原子半径最大的主族元素是Na元素,在前三周期中Na的原子半径最大,所以D是Na元素;单质是淡黄色固体的元素是S,硫单质是淡黄色固体,所以E是S元素;最高正价与最低负价代数和为6的最低价位-1,最高价为+7,所以F是Cl元素。
(1)N原子的外围电子是2s22p3,电子排布图为 ;NH3分子中N原子的价层电子对数是3+1/2(5-3)=4,所以N原子的杂化方式是sp3杂化;
;NH3分子中N原子的价层电子对数是3+1/2(5-3)=4,所以N原子的杂化方式是sp3杂化;
(2)S与Cl比,Cl的电负性大于S,因为同周期中,随核电荷数的增加,原子吸引电子的能力增强;
(3)①用石灰石与稀盐酸反应制取二氧化碳气体,可以用如图装置,正确;②Al常温下与浓硝酸发生钝化,反应停止,所以可用Al槽车运输浓硝酸,正确;③Al的核电荷数大,原子半径小于Na,所以金属键较强,熔点高,错误;④S的非金属性比Cl弱,所以气态氢化物的稳定性比Cl弱,错误,答案选①②;
(4)使品红溶液褪色的含S化合物是二氧化硫,根据沉淀中的元素分析,含Cl:35.7%,Cu:64.3%,可知该沉淀中Cl与Cu的原子个数比是35.7/35.5:64.3/64=1:1,所以该沉淀的化学式是CuCl,所以Cu元素的化合价从+2价降低为+1价,所以硫酸铜做氧化剂,则二氧化硫是还原剂,答案选C。
考点:考查元素的推断,元素周期律的应用,电子排布图、杂化方式的判断,化学式的判断


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014-2015学年四川邛崃市高二上学期第一次月考化学试卷(解析版) 题型:选择题
现有四种元素的基态原子的电子排布式如下:
①1s22s22p63s23p4②1s22s22p63s23p3③1s22s22p3④1s22s22p5则下列有关比较中正确的是
A.第一电离能:④>③>②>①
B.原子半径:④>③>②>①
C.电负性:④>③>②>①
D.最高正化合价:①>③>②>④
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川邛崃市高二上学期第一次月考化学试卷(解析版) 题型:选择题
元素周期表中铋元素的数据见下图,下列说法正确的是

A、Bi元素的质量数是209
B.Bi元素的相对原子质量是209.0
C.Bi原子6p能级上有一个未成对电子
D.Bi原子最外层有5个能量相同的电子
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川邛崃市高三上学期第一次月考化学试卷(解析版) 题型:选择题
已知Fe3O4可表示成(FeO?Fe2O3),水热法制备Fe3O4纳米颗粒的总反应为:
3Fe2++2S2O32-+O2+4OH—=Fe3O4+S4O62-+2H2O,下列说法不正确的是
A.参加反应的氧化剂与还原剂的物质的量之比为1:5
B.若有2molFe2+被氧化,则被Fe2+还原的O2为0.5mol
C.每生成1molFe3O4,则转移电子数为4mol
D.O2是氧化剂,S2O32-和Fe2+是还原剂
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省邛崃市高二上学期半期考试化学试卷(解析版) 题型:选择题
X、Y、Z、W是原子序数依次增大的短周期元素,且互不同族,其中只有两种为金属;X原子的最外层电子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9 ,单质Y可与NaOH溶液反应生成氢气。下列说法不正确的是
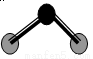
A.原子半径:Y>Z>W
B.XW2熔点为107℃,沸点为142.5℃,说明固态XW2为分子晶体
C.电解YW3固体可得单质Y
D.ZW2分子结构见上图,说明ZW2是极性分子
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省邛崃市高二上学期半期考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.分子晶体中一定不含离子键,但一定存在共价键
B.金属与非金属元素形成的化合物一定是离子化合物
C.NCl3分子中所有的原子均为8电子稳定结构
D.NaHSO4晶体中阴、阳离子的个数比是1∶2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高一10月月考化学试卷(解析版) 题型:填空题
(6分)有一包白色固体,可能含有NaCl、KCl、Na2SO4、BaCl2和Na2CO3中的一种或几种,为探究其成分,某同学做了如下实验:
(1)将此白色固体取样,溶解于水,有白色沉淀生成;
(2)过滤出沉淀,并将沉淀移入试管中,加入稀盐酸,沉淀完全溶解并有气体生成;
(3)向上述滤液中加入硝酸银溶液,有白色沉淀生成,再加稀硝酸沉淀不溶解。通过上述实验现象分析:该白色固体中一定含有的物质是 ,一定不含的物质是 ,不能确定的是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省成都外国语学校高二上学期期中化学试卷(解析版) 题型:选择题
下列对各组物质性质的比较中,正确的是
A.硬度:Li>Na>K
B.熔点:金刚石>晶体硅>二氧化硅>碳化硅
C.第一电离能:Na<Mg<Al
D.空间利用率:六方密堆<面心立方<体心立方
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com