
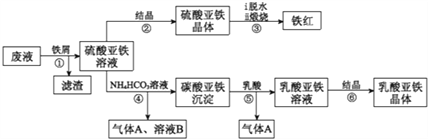
����Ŀ��������ⷨ���Ѱ۲����ķ�Һ[���д���FeSO4��H2SO4������Fe2(SO4)3��TiOSO4]��������Ͳ�Ѫ�������������������������£�
��֪:TiOSO4������ˮ����ˮ�п��Ե���ΪTIO2+��SO42-��TiOSO4ˮ���TiO2��xH2O����Ϊ���淴Ӧ������ṹ��ʽΪCH3CH(OHCOOH.��ش�
(1)������з�������������Һ�������IJ�����______________��
(2)������м��Ŀһ�ǻ�ԭ����Fe2(SO4)3������ʹ����TiOSO4ת��ΪTiO2��xH2O��������ƽ���ƶ���ԭ�����͵õ�������ԭ��_______________��
(3)���������ڿ�������������������������÷�Ӧ���������ͻ�ԭ�������ʵ���֮��Ϊ_____________��
(4)�����ӷ���ʽ���Ͳ�����м������ܵõ�����������ԭ��___________________��
(5)����ܵ����ӷ���ʽ��________________��
(6)����ޱ������һ������նȣ�ԭ��������������ˮ�Լ�_______________��
(7)������������{[CH3CH(OH)COO]2Fe��3H2O}���ȵIJ���������KMnO4�ζ����ⶨ��Ʒ��Fe�����������㴿��ʱ�����ֽ�����Ǵ���100%����ԭ�������_______________��
������������Ce(SO4)2����Һ�ζ����вⶨ����Ӧ��Ce4+���ӵĻ�ԭ����ΪCe3+���ⶨʱ���ȳ�ȡ5.760g��Ʒ���ܽ����б�Ҫ������������ƿ���Ƴ�250mL��Һ��ÿ��ȡ25.00mL����0.1000mol/LCe(SO4)2����Һ�ζ����յ��¼�������±���
�ζ����� | 0.1000mol/LCe(SO4)2����Һ/mL | |
�ζ�ǰ���� | �ζ������ | |
1 | 0.10 | 19.85 |
2 | 0.12 | 21.32 |
3 | 1.05 | 20.70 |
4 | 0.16 | 19.88 |
���Ʒ��������������Ĵ���Ϊ_______(������������ʾ)��
���𰸡� ���� TiOSO4+(x+1)H2O![]() TiO2 xH2O��+H2SO4��TiO2++(x+1)H2O
TiO2 xH2O��+H2SO4��TiO2++(x+1)H2O![]() TiO2 xH2O��+2H+��м��H2SO4��Ӧ��c(H+)���ͣ�ʹƽ�������ƶ���TiOSO4ת��ΪTiO2xH2O���� 1: 4 FeCO3+2CH3CH(OH)COOH== Fe2++2CH3CH(OH)COO-+H2O+CO2�� Fe2++2HCO3-==FeCO3��+H2O+CO2�� ��ֹFe2+������ ��������ǻ�(��OH)�����Ը��������Һ���� 98.5%�� 0.985
TiO2 xH2O��+2H+��м��H2SO4��Ӧ��c(H+)���ͣ�ʹƽ�������ƶ���TiOSO4ת��ΪTiO2xH2O���� 1: 4 FeCO3+2CH3CH(OH)COOH== Fe2++2CH3CH(OH)COO-+H2O+CO2�� Fe2++2HCO3-==FeCO3��+H2O+CO2�� ��ֹFe2+������ ��������ǻ�(��OH)�����Ը��������Һ���� 98.5%�� 0.985
�������������������1��ʵ�ֹ����Һ��ķ����ù��˵ķ�����(2) TiO2++(x+1)H2O![]() TiO2 xH2O��+2H+����м��H2SO4��Ӧ��c(H+)������(3)���������ڿ��������������������������ķ���ʽΪ��4FeSO4+O2
TiO2 xH2O��+2H+����м��H2SO4��Ӧ��c(H+)������(3)���������ڿ��������������������������ķ���ʽΪ��4FeSO4+O2![]() 2Fe2O3+4SO3������������������ԭ������������(4) ̼���������������ܽ�ƽ�⣺FeCO3��s��Fe2+��aq��+CO32-��aq�����������ᣬCO32-�����ᷴӦŨ�Ƚ��ͣ�ƽ�������ƶ���ʹ̼�������ܽ�õ�����������Һ��(5)������ͼ��֪������������̼����立�Ӧ����̼������������������Ϊ������̼��(6)���������ױ��������������Բ���ޱ������һ������նȣ�(7) [CH3CH(OH)COO]2Fe��3H2O�е�������������������ǻ�(��OH)���ܱ����Ը��������Һ���������ݱ������ݣ��ڶ��βⶨ����ƫ��������Χ�����õ�һ�����������Ĵ�ʵ�����ݣ�ƽ������0.1000mol/LCe(SO4)2����Һ19.70mL�����ݹ�ϵʽ
2Fe2O3+4SO3������������������ԭ������������(4) ̼���������������ܽ�ƽ�⣺FeCO3��s��Fe2+��aq��+CO32-��aq�����������ᣬCO32-�����ᷴӦŨ�Ƚ��ͣ�ƽ�������ƶ���ʹ̼�������ܽ�õ�����������Һ��(5)������ͼ��֪������������̼����立�Ӧ����̼������������������Ϊ������̼��(6)���������ױ��������������Բ���ޱ������һ������նȣ�(7) [CH3CH(OH)COO]2Fe��3H2O�е�������������������ǻ�(��OH)���ܱ����Ը��������Һ���������ݱ������ݣ��ڶ��βⶨ����ƫ��������Χ�����õ�һ�����������Ĵ�ʵ�����ݣ�ƽ������0.1000mol/LCe(SO4)2����Һ19.70mL�����ݹ�ϵʽ![]() ���㴿����
���㴿����
��������1��ʵ�ֹ����Һ��ķ����ù��˵ķ�����(2) TiO2++(x+1)H2O![]() TiO2 xH2O��+2H+����м��H2SO4��Ӧ��c(H+)������ʹƽ�������ƶ���TiOSO4ת��ΪTiO2xH2O������(3)���������ڿ��������������������������ķ���ʽΪ��4FeSO4+O2
TiO2 xH2O��+2H+����м��H2SO4��Ӧ��c(H+)������ʹƽ�������ƶ���TiOSO4ת��ΪTiO2xH2O������(3)���������ڿ��������������������������ķ���ʽΪ��4FeSO4+O2![]() 2Fe2O3+4SO3������������������ԭ�����������������������ͻ�ԭ�������ʵ���֮��Ϊ1��4��(4) ̼���������������ܽ�ƽ�⣺FeCO3��s��Fe2+��aq��+CO32-��aq�����������ᣬCO32-�����ᷴӦŨ�Ƚ��ͣ�ƽ�������ƶ���ʹ̼�������ܽ�õ�����������Һ����Ӧ����ʽ��FeCO3+2CH3CH(OH)COOH== Fe2++2CH3CH(OH)COO-+H2O+CO2����(5)������ͼ��֪������������̼����立�Ӧ����̼������������������Ϊ������̼����Ӧ���ӷ���ʽ��Fe2++2HCO3-==FeCO3��+H2O+CO2����(6)���������ױ��������������Բ���ޱ������һ������նȣ����Կ���һ������ն�����������ˮ���ܷ�ֹFe2+��������(7) [CH3CH(OH)COO]2Fe��3H2O�е�������������������ǻ�(��OH)���ܱ����Ը��������Һ���������Խ�����Ǵ���100%����25mL��Һ����CH3CH(OH)COO]2Fe��3H2O�����ʵ���xg��
2Fe2O3+4SO3������������������ԭ�����������������������ͻ�ԭ�������ʵ���֮��Ϊ1��4��(4) ̼���������������ܽ�ƽ�⣺FeCO3��s��Fe2+��aq��+CO32-��aq�����������ᣬCO32-�����ᷴӦŨ�Ƚ��ͣ�ƽ�������ƶ���ʹ̼�������ܽ�õ�����������Һ����Ӧ����ʽ��FeCO3+2CH3CH(OH)COOH== Fe2++2CH3CH(OH)COO-+H2O+CO2����(5)������ͼ��֪������������̼����立�Ӧ����̼������������������Ϊ������̼����Ӧ���ӷ���ʽ��Fe2++2HCO3-==FeCO3��+H2O+CO2����(6)���������ױ��������������Բ���ޱ������һ������նȣ����Կ���һ������ն�����������ˮ���ܷ�ֹFe2+��������(7) [CH3CH(OH)COO]2Fe��3H2O�е�������������������ǻ�(��OH)���ܱ����Ը��������Һ���������Խ�����Ǵ���100%����25mL��Һ����CH3CH(OH)COO]2Fe��3H2O�����ʵ���xg��
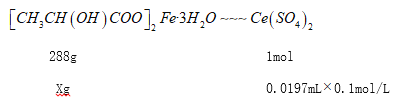
![]()
X=0.56736g����Ʒ��������������Ĵ���Ϊ![]() ��
��


 �»����ܶ�Ա��ϵ�д�
�»����ܶ�Ա��ϵ�д� ����ͼ����ּ��������ҵ֣�ݴ�ѧ������ϵ�д�
����ͼ����ּ��������ҵ֣�ݴ�ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ӻ�Br-�ķ�Һ����ȡ�嵥�ʣ��辭��һϵ�в�����ʵ��װ�ü����ʵ�����������

Br2 | CCl4 | ��ʮ���� | |
�ܶ�/g��cm-3 | 3. 12 | 1.59 | 0.753 |
�е�/�� | 58.76 | 76.8 | 215��217 |
����˵������ȷ����
A. ����װ�ü�������Һ�е�Br-
B. װ������ѡ����ʮ���������CCl4������Ϊ��ʮ������ܶȸ�С
C. ��װ�ñ������������ռ���ʮ�������ռ�Br2
D. ��װ�ö���������Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Цġ��á������־���ṹ�����������Ǧġ��á������־����ڲ�ͬ�¶���ת����ͼʾ�������й�˵���в���ȷ���� ( )

�ģ�Fe![]() �ã�Fe
�ã�Fe![]() ����Fe
����Fe
A���ģ�Fe������ÿ��Feԭ�Ӿ�������������Feԭ����8��
B���ã�Fe������ÿ��Feԭ�Ӿ�������������Feԭ����12��
C��ͼ�Ц���Fe�����߳���Ϊa cm���ģ�Fe�����߳���Ϊb cm�������־�����ܶȱ�Ϊb3:a3
D����Fe���ȵ�1 500���ֱ�����ȴ�ͻ�����ȴ���õ��ľ���������ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2KMnO4+16HCl�T2KCl+2MnCl2+5Cl2��+8����Ӧ�У���ȷ���ǣ�������
A.Cl2�ǻ�ԭ����
B.������Ӧ������ΪH2O
C.�������뻹ԭ�����ʵ���֮��Ϊ1��8
D.��1mol KMnO4�μӷ�Ӧ��ת�Ƶĵ��ӵ����ʵ�����4mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й����ʷ����������ȷ����
A.CaCl2��NaOH��HCl��O2�������ʶ����ڻ�����
B.��Һ����Һ�����嶼���ڻ����
C.���ᡢ��������ƺ���ʯ�ҷֱ������ᡢ��κ�������
D.CO2��CO�ȷǽ������������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʱ��������ѧ��Ӧ�߱�һ���Ļ�ѧ��ѧ���������������У������ϻ�ѧ����ԭ������
A. ������ڵ���������ȡ����������������������
B. ��������Ⱦ�һ�������»����ܲ���������Ⱦ
C. ����������һ��������ͭ�ƳɺϽ𣬷�ֹ����Ʒ����ʴ
D. ���������ĸ��������Ǵ�Դͷ�Ͽ����γ���������Ⱦ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������һ����ɫ��������������Դ����ͼ����ɫ��Դ��������ȼ�ϵ�ء��Ĺ���ԭ��ʾ��ͼ��a ��b��Ϊ�����Pt�缫���õ�ع���ʱ������˵������ȷ����
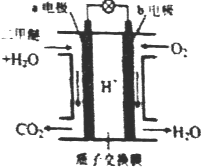
A. a�缫Ϊ�õ������
B. ��ع���ʱ��ȼ�ϵ���ڲ�H+��b�缫����a�缫
C. ��ع���ʱ��b�缫��Ӧʽ��O2+4e-+2H2O=4OH-
D. ��ع���ʱ��a�缫��Ӧʽ��CH3OCH3-12e-+3H2O=2CO2��+12H+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�д���5�����ӣ�NO3-��SO42-��Fe3+��H+��R���ӣ������ʵ���֮��Ϊ2��3��1��3��1����R����Ϊ
A. Ca2+ B. Mg2+ C. Cl- D. Ba2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£��������ʵ��ܶȻ��������±���
���� | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
Ksp | 2.2��10��20 | 2.6��10��39 | 1.7��10��7 | 1.3��10��12 |
��1��ij����CuCl2��Һ�к�������FeCl3��Ϊ�Ƶô���CuCl2��Һ���˼���__________������Һ����pH��4��ʹFe3��ת��ΪFe(OH)3��������ʱ��Һ�е�c(Fe3��)��____________________ mol��L��1��
��2��������Һ���˺�������Һ����________��________(������˳����дʵ�鲽�������)���پ����ˣ��ɵõ�CuCl2��2H2O���塣
��3��ijѧϰС���á���ӵ��������ⶨ����CuCl2��2H2O���������(��������I��������Ӧ������������)�Ĵ��ȣ��������£�ȡ0.800 g��������ˮ�������ʵ�������KI���壬��ַ�Ӧ�����ɰ�ɫ��������0.100 0 mol��L��1Na2S2O3����Һ�ζ�������ζ��յ�ʱ������Na2S2O3����Һ40.00 mL(��֪��I2��2S2O![]() ===S4O
===S4O![]() ��2I�� )��
��2I�� )��
�ٿ�ѡ��________���ζ�ָʾ�����ζ��յ��������______________________��
��CuCl2��Һ��KI��Ӧ�����ӷ���ʽΪ________________________________��
�ۺ���CuCl2��2H2O����������Ĵ�����__________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com