
【题目】可逆反应N2+3H2![]() 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是( )
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是( )
A.3v正(N2)=v正(H2)B.v正(N2)=v逆(NH3)
C.v正(N2)=3v逆(H2)D.2v正(H2)=3v逆(NH3)
科目:高中化学 来源: 题型:
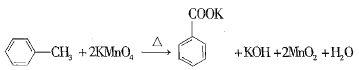
【题目】苯甲酸又称安息香酸,结构简式为![]() ,有关性质如表所示。苯甲酸可用于合成纤维、树脂、涂料等,也可作为药物或防腐剂使用,有抑制真菌、细菌生长的作用。实验室用高锰酸钾氧化甲苯可制得苯甲酸,相关反应方程式如下:
,有关性质如表所示。苯甲酸可用于合成纤维、树脂、涂料等,也可作为药物或防腐剂使用,有抑制真菌、细菌生长的作用。实验室用高锰酸钾氧化甲苯可制得苯甲酸,相关反应方程式如下:
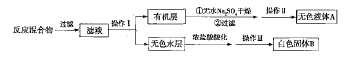
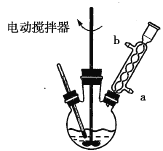
实验时,将一定量的甲苯和高锰酸钾溶液置于图示装置中,在100℃下反应一段时间,再停止反应,并按如下流程分离出苯甲酸和回收未反应的甲苯。
熔点/℃ | 122.4 |
沸点/℃ | 249 |
密度/( | 1.2659 |
水溶性 | 微溶 |
(1)实验中用电动搅拌器进行搅拌的目的是________________。
(2)冷凝管中冷却水是从________(填“a”或“b”)口进入。
(3)操作Ⅰ的名称是,所需的玻璃仪器有________、烧杯;操作Ⅱ的名称是________。
(4)水层用浓盐酸酸化的相关化学方程式为_________________。
(5)如果滤液呈紫色,则要先加入还原剂亚硫酸氢钾,然后再加入浓盐酸酸化,若无此操作会出现的危害是_______________________。
(6)无色液体A的主要成分是________,白色固体B的主要成分是________。
(7)为测定所得产品的纯度,称取1.220g产品,配成![]() 溶液,取其中
溶液,取其中![]() 溶液进行滴定,消耗
溶液进行滴定,消耗![]() 的物质的量为
的物质的量为![]() ,则产品中苯甲酸的质量分数为________。
,则产品中苯甲酸的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种化合物,有的是药物,有的是香料。它们的结构简式如图所示:

(1)化合物A的分子式是___;A中含有的官能团的名称是___。
(2)A、B、C、D四种化合物中互为同分异构体的是___。(填序号)
(3)化合物B的核磁共振氢谱中出现___组峰。
(4)1molD最多能与___mol的氢气发生加成反应;1molD与足量Br2水混合,最多能和___ molBr2发生反应
(5)已知C的一种同分异构体满足:①能够发生水解反应;②能够发生银镜反应;③能够使FeCl3溶液显紫色;④苯环上的一氯代物有2种。请写出它的结构简式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)是第四周期ⅤA族元素,可以形成As2O3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图____________。
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式________。该反应需要在加压下进行,原因是________。
(3)已知:As(s)+![]() H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+![]() O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
2As(s)+![]() O2(g) =As2O5(s) ΔH3
O2(g) =As2O5(s) ΔH3
则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH =_________。
(4)298 K时,将20 mL 3x mol·L1 Na3AsO3、20 mL 3x mol·L1 I2和20 mL NaOH溶液混合,发生反应:AsO33(aq)+I2(aq)+2OH![]() AsO43(aq)+2I(aq)+ H2O(l)。溶液中c(AsO43)与反应时间(t)的关系如图所示。
AsO43(aq)+2I(aq)+ H2O(l)。溶液中c(AsO43)与反应时间(t)的关系如图所示。

①下列可判断反应达到平衡的是__________(填标号)。
a.溶液的pH不再变化
b.v(I)=2v(AsO33)
c. c (AsO43)/c (AsO33)不再变化
d. c(I)=y mol·L1
②tm时,v正_____ v逆(填“大于”“小于”或“等于”)。
③tm时v逆_____ tn时v逆(填“大于”“小于”或“等于”),理由是_____________。
④若平衡时溶液的pH=14,则该反应的平衡常数K为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸松油酯是松油醇的酯化产物,具有甜香气味,广泛应用于日用和食用香精中。乙酸松油酯的结构简式如图甲所示,下列说法正确的是
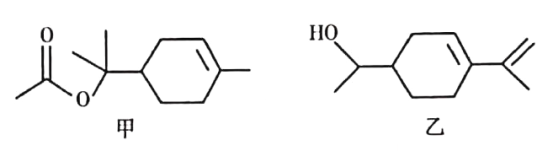
A. 乙酸松油酯的分子式为C12H22O2
B. 乙酸松油酯的水解产物松油醇与图乙所示物质互为同分异构体
C. 乙酸松油酯既易溶于水、也易溶于乙醇或油脂
D. 乙酸松油酯能使Br2的CCl4溶液或酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现取m g镁铝合金在一定浓度的稀硝酸中恰好完全溶解(硝酸的还原产物只有NO),向反应后的混合溶液中滴加b mol/LNaOH溶液,当滴加到V mL时,得到沉淀质量恰好为最大值n g ,则下列有关该说法中不正确的有( )
A.标准状况下生成N的体积为![]() L
L
B.沉淀中OH-的质量为17bVg
C.恰好溶解后溶液中的NO3-的物质的量为![]() mol
mol
D.与合金反应的硝酸的物质的量为(![]() +
+![]() )mol
)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨氮(水中以NH3和NH4+形式存在的氮)含量是环境水体污染的一项重要指标,其氧化过程会造成水体中溶解氧浓度降低,导致水质下降,影响水生动植物的生长。
(1)水中NH3和NH4+两者的浓度比取决于水体的pH和水温。当pH偏高时,___比例较高,原因是___(请用离子方程式表示)。
(2)空气吹脱法是目前消除NH3对水体污染的重要方法。在一定条件下,向水体中加入适量NaOH充分反应后,再向水中通入空气,可增大NH3的脱除率,用平衡移动原理解释其原因:___。
(3)在微生物作用下,蛋白质在水中分解产生的NH3能够被O2氧化生成亚硝酸(HNO2)。
___NH3+__O2→__HNO2+__________
①请将上述化学方程式补充完整,并配平。
②反应中氧化剂与还原剂的物质的量之比为___。
③若反应中有0.6mol电子发生转移,生成亚硝酸的质量为___。
(4)水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示。DO的测定原理如下:
①2Mn2++O2+4OH-→2MnO(OH)2↓
②MnO(OH)2+2I-+4H+→Mn2++I2+3H2O
③2S2O32-+I2→S4O62-+2I-
某小组同学取100.00mL水样经反应①和②后,取出20.00mL溶液,以淀粉作指示剂,用amol/LNa2S2O3溶液进行滴定,终点现象为___;滴定消耗Na2S2O3溶液bmL,水样的DO=____mg/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A.用铜作电极电解硫酸铜溶液: 2Cu2+ + 2H2O ![]() 2Cu+ O2↑+4H+
2Cu+ O2↑+4H+
B.用银氨溶液检验乙醛中的醛基: CH3CHO+2Ag(NH3)2++2OH-![]() CH3COO-+NH4++3NH3+2Ag↓+H2O
CH3COO-+NH4++3NH3+2Ag↓+H2O
C.苯酚钠溶液中通入少量的CO2: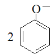 +H2O
+H2O![]()
![]() +CO32-
+CO32-
D.氢氧燃料电池的负极反应式:O2 + 2H2O + 4e-= 4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在密闭容器中进行的反应:COCl2(g)CO(g)+Cl2(g)△H=108kJ·mol-1,在4min、10min、14min时均只改变影响平衡的一个条件,各物质的浓度变化如图所示:
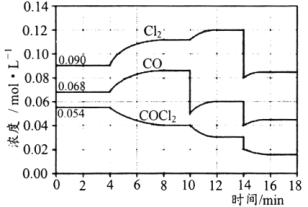
下列说法正确的是( )
A.4min时改变的条件是:降低体系的温度
B.10min时改变的条件是:向体系中再充入Cl2
C.14min时改变的条件是:增大容器的体积
D.若T℃时,起始向2L的恒容密闭容器中充入COCl2、Cl2、CO均为0.20mol,则达到平衡前,v正>v逆
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com