
����Ŀ��T��ʱ�����ܱ������н��еķ�Ӧ��COCl2(g)CO(g)+Cl2(g)��H=108kJ��mol-1����4min��10min��14minʱ��ֻ�ı�Ӱ��ƽ���һ�������������ʵ�Ũ�ȱ仯��ͼ��ʾ��
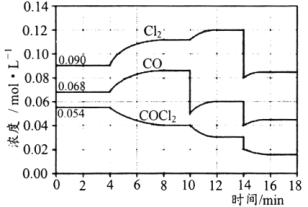
����˵����ȷ���ǣ� ��
A.4minʱ�ı�������ǣ�������ϵ���¶�
B.10minʱ�ı�������ǣ�����ϵ���ٳ���Cl2
C.14minʱ�ı�������ǣ��������������
D.��T��ʱ����ʼ��2L�ĺ����ܱ������г���COCl2��Cl2��CO��Ϊ0.20mol����ﵽƽ��ǰ��v��>v��
���𰸡�CD
��������
A.��ͼ��֪��4min˲��Ũ�Ȳ��䣬�������Ǹı�ѹǿ��Ũ�ȣ�Ӧ�Ǹı��¶ȣ���ʱ��Ӧ���Ũ�ȼ�С������Ũ�����ӣ�˵��ƽ�������ƶ���������Ϊ���ȷ�Ӧ����Ӧ���������¶ȣ� ��A����
B.10min˲������Ũ�Ȳ��䣬CO��Ũ�Ƚ��ͣ��ʸı�����Ϊ�����CO����B����
C.14min˲������ʵ�Ũ��ͬʱ��С����ƽ�������ƶ���ӦΪ�����������������Сѹǿ����C��ȷ��
D. T��ʱ��ͼ�����ɵ�ƽ�ⳣ��K=![]() ������ʼ��2L�ĺ����ܱ������г���COCl2��Cl2��CO��Ϊ0.20mol����Qc=
������ʼ��2L�ĺ����ܱ������г���COCl2��Cl2��CO��Ϊ0.20mol����Qc=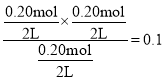 <K����Ӧ������У�v��>v������D��ȷ��
<K����Ӧ������У�v��>v������D��ȷ��
��ѡ��CD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴ӦN2+3H2![]() 2NH3�������淴Ӧ���ʿ��ø���Ӧ���������Ũ�ȵı仯����ʾ�����и���ϵ����˵����Ӧ�Ѵﵽƽ��״̬���ǣ� ��
2NH3�������淴Ӧ���ʿ��ø���Ӧ���������Ũ�ȵı仯����ʾ�����и���ϵ����˵����Ӧ�Ѵﵽƽ��״̬���ǣ� ��
A.3v��(N2)=v��(H2)B.v��(N2)=v��(NH3)
C.v��(N2)=3v��(H2)D.2v��(H2)=3v��(NH3)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ������ӵ�أ������������¿ɽ���ѭ����ŵ磬ʵ�ֶԴ��ԵĿ�����ء�һ��Ϊ����Fe2O3����һ��Ϊ����﮺�ʯī�ĸ��ϲ��ϣ������ֻ��������ӡ�����ܷ�ӦΪ��Fe2O3+6Li![]() 2Fe+3Li2O�����ڴ˵�أ�����˵������ȷ����
2Fe+3Li2O�����ڴ˵�أ�����˵������ȷ����
A.�ŵ�ʱ���˵����������
B.�ŵ�ʱ��������ӦΪFe2O3+6Li++6e-= 2Fe+3Li2O
C.�ŵ�ʱ������������С��������������
D.���ʱ��������ӦΪLi++e-=Li
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���⡢����������þ������ͭ��п��Ԫ�ؼ��仯���������ǵ��ճ����������Ź㷺����;���ش���������:
��1��ijͬѧ������ѧ֪ʶ���ƶ�Mg��̬ԭ�ӵĺ�������Ų�Ϊ��
![]()
��ͬѧ�����ĵ����Ų�ͼΥ����________________________________��
��2��Feλ��___________��_______����Fe2���۵����Ų�ʽΪ_____________��
��3��MgCO3�ķֽ��¶�____ BaCO3 ������>�� ����<����
��4��C��N��OԪ�صĵ�һ�������ɴ�С��˳��Ϊ_________________
��5��1mol[Cu(NH3)2]���к�����������ĿΪ___________
��6�������й�˵������ȷ����____��
A�����ȶ��ԣ�NH3 >PH3��ԭ����NH3���Ӽ�����������PH3���Ӽ���ڷ��»���
B��SO2��CO2�Ļ�ѧ������Щ���ƣ����ռ�ṹ���ӻ���ʽ��ͬ
C���ۡ��е�: SiF4< SiCl4< SiBr4 <SiI4 , ԭ���Ƿ����й��ۼ�����������
D���۵�: CaO > KCl > KBr��ԭ���Ǿ�������С
��7������Cu�Ķѻ���ʽ��ͼ��ʾ������Cuԭ���ڶ�άƽ�������ʱ����λ��Ϊ_________����Cuԭ�Ӱ뾶Ϊa������Ŀռ�������Ϊ______�����ú�����a����ʽ�ӱ�ʾ�����ػ���

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������̵���Ҫ������ͳ��õ��������������ǹ�ҵ�������̿��Ʊ�������ص�һ�ֹ������̡�
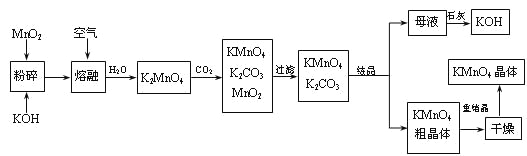
��1��KMnO4ϡ��Һ��һ�ֳ��õ�������������������������___������ţ��������ơ�
A��75%�ƾ� B��˫��ˮ C������ D��84����Һ��NaClO��Һ��
��2��д��MnO2��KOH�����ڻ������ͨ�����ʱ��������Ҫ��Ӧ�Ļ�ѧ����ʽ��
___________________________________________________________________��
��3����K2MnO4��Һ��ͨ��CO2���Ʊ�KMnO4���÷�Ӧ�еĻ�ԭ���ǣ�_______��
��4�����������п���ѭ��ʹ�õ�������ʯ�ҡ�������̼��___��___��д��ѧʽ����
��5��������������ѭ�����Ʊ������е���ʧ����1 mol MnO2���Ƶ�_____mol KMnO4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪: 25�桢101 kPa�£��� 2 Na(s) + 1/2 O2(g) = Na2O(s) ��H1 = - 414 kJ / mol
�� 2 Na(s) + O2(g) = Na2O2(s) ��H2 = - 511 kJ / mol
����˵����ȷ����
A. ������������������Ӹ����Ȳ����
B. ���������ɵ����ʵ����IJ��ת�Ƶ�������ͬ
C. ������Na������O2��Ӧ����Na2O�����¶���������Na2O�������ӿ�
D. 25�桢101 kPa�£�Na2O2(s) + 2 Na(s) = 2 Na2O(s) ��H = -317 kJ / mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ï��������ȼ�ϵĽ������̼����������ȡ�ʵ�����Ʊ���ï��װ��ʾ��ͼ��ͼһ��

��֪���ٶ�ï���۵���173�棬��100��ʱ��ʼ�������е���249��
���Ʊ���ï���ķ�Ӧԭ���ǣ�2KOH+FeCl2+2C5H6=Fe(C5H5)2+2KCl+2H2O
ʵ�鲽��Ϊ��
����������ƿ�м���25g��ĩ״��KOH����������a�м���60mL��ˮ���ѵ���ƿ�У���ֽ��裬ͬʱͨ����Լ10min��
���ٴ�����a����5.5mL������Ļ����ϩ(C5H6���ܶ�Ϊ0.95g/cm3)�����裻
�۽�6.5g��ˮFeCl2��(CH3)2SO(�������������ܼ�)��ɵ���Һ25mLװ������a�У�������������c�У�45min���꣬��������45min��
���ٴ�����a����25mL��ˮ���ѽ��裻
�ݽ�c�е�Һ��ת���Һ©���У����������ᡢˮ��ϴ�����Σ���Һ�óȻ�ɫ��Һ��
�������Ȼ�ɫ��Һ���ö�ï���ֲ�Ʒ��
�ش��������⣺
��1������b��������___��
��2���������ͨ�뵪����Ŀ����___��
��3������c�������ݻ�ӦΪ(ѡ���)��___��
��100mL ��250mL ��500mL
��4�������������ϴ�ӵ�Ŀ����___��
��5��������Ƕ�ï���ֲ�Ʒ���ᴿ���ù�����ͼ���н��У����������Ϊ___���ò���������������___��
��6���������Ƶô����Ķ�ï��4.3g�����ʵ��IJ���Ϊ___(������λ��Ч����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������[HPO(OC2H5)2]��һ��Һ̬��ȼ���ܼ���ʵ���Ҳ���PCl3����ˮ�Ҵ��Ʊ��ߴ������������������Ӧ����ʽΪ��PCl3 + 4C2H5OH �� HPO(OC2H5)2 + HCl��+2C2H5Cl + H2O��ʵ�鲽�����£�

�ٽ�45 mL CHCl3��46.00 g��1.0 mol����ˮ�Ҵ���Ϻ����250 mL������ƿ�С�
�ڴ�����A�еμ�20 mL CHCl3��41.25 g ��0.3 mol��PCl3�����Һ���ñ�ˮ����6��8�棬������������Լ1 h�μ���ϡ�
�۽���Ӧ�ﵹ���ձ��У���10%��Na2CO3��Һ����pH��7��8������ȥ����ˮϴ�����Σ�������B�з��롣
�ܼ�ѹ�����ռ���Ʒ����29.60 g��Ʒ��
��1��װ��ͼ������AΪ��ѹ��Һ©��������֧�ܵ�����Ϊ______������©��������Ϊ______�������������B����Ϊ______��
��2����̼������Һϴ�ӵ�Ŀ����Ϊ�˳�ȥ��������______���ѧʽ���Լ�PCl3��
��3������ˮ�Ҵ����ýǶȼ��㣬����ʵ�����Ϊ______������ֵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�ܱ������У���ӦmA(g)��nB(s)![]() 3C(g)�ﵽƽ��ʱ�����c(A)Ϊ0.5 mol/L�����¶Ȳ��������£����ݻ�����һ�������ﵽ�µ�ƽ��ʱ�����c(A)Ϊ0.3 mol/L���������жϲ���ȷ����
3C(g)�ﵽƽ��ʱ�����c(A)Ϊ0.5 mol/L�����¶Ȳ��������£����ݻ�����һ�������ﵽ�µ�ƽ��ʱ�����c(A)Ϊ0.3 mol/L���������жϲ���ȷ����
A.��������ܶ�һ����СB.ƽ��һ�����淴Ӧ�����ƶ�
C.��ѧ��������m+n>3D.����C���������������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com