
ΓΨΧβΡΩΓΩœ÷»Γm gΟΨ¬ΝΚœΫπ‘Ύ“ΜΕ®≈®Ε»ΒΡœΓœθΥα÷–«ΓΚΟΆξ»Ϊ»ήΫβ(œθΥαΒΡΜΙ‘≠≤ζΈο÷Μ”–NO)Θ§œρΖ¥”ΠΚσΒΡΜλΚœ»ή“Κ÷–ΒΈΦ”b mol/LNaOH»ή“ΚΘ§Β±ΒΈΦ”ΒΫV mL ±Θ§ΒΟΒΫ≥ΝΒμ÷ ΝΩ«ΓΚΟΈΣΉν¥σ÷Βn g Θ§‘ρœ¬Ν–”–ΙΊΗΟΥΒΖ®÷–≤Μ’ΐ»ΖΒΡ”–Θ® Θ©
A.±ξΉΦΉ¥Ωωœ¬…ζ≥…NΒΡΧεΜΐΈΣ![]() L
L
B.≥ΝΒμ÷–OH-ΒΡ÷ ΝΩΈΣ17bVg
C.«ΓΚΟ»ήΫβΚσ»ή“Κ÷–ΒΡNO3-ΒΡΈο÷ ΒΡΝΩΈΣ![]() mol
mol
D.”κΚœΫπΖ¥”ΠΒΡœθΥαΒΡΈο÷ ΒΡΝΩΈΣ(![]() +
+![]() )mol
)mol
ΓΨ¥πΑΗΓΩB
ΓΨΫβΈωΓΩ
AΓΔΗυΨίΒγΉ” ΊΚψ‘≠άμΘ§…ζ≥…NO ±Θ§![]() ÷–
÷–![]() ΦέΒΡN‘≠Ή”ΒΟ3ΗωΒγΉ”Θ§“ρ¥Υ…ζ≥…NOΒΡΈο÷ ΒΡΝΩ”ΠΗΟ «ΉΣ“ΤΒγΉ”ΒΡ»ΐΖ÷÷°“ΜΘ§Φ¥
ΦέΒΡN‘≠Ή”ΒΟ3ΗωΒγΉ”Θ§“ρ¥Υ…ζ≥…NOΒΡΈο÷ ΒΡΝΩ”ΠΗΟ «ΉΣ“ΤΒγΉ”ΒΡ»ΐΖ÷÷°“ΜΘ§Φ¥![]() Θ§ΤδΧεΜΐ‘Ύ±ξΉΦΉ¥Ωωœ¬ΈΣ
Θ§ΤδΧεΜΐ‘Ύ±ξΉΦΉ¥Ωωœ¬ΈΣ![]() Θ§Ι A’ΐ»ΖΘΜ
Θ§Ι A’ΐ»ΖΘΜ
BΓΔ≥ΝΒμΈΣ«β―θΜ·¬ΝΚΆ«β―θΜ·ΟΨΘ§≥ΝΒμ÷ ΝΩΒ»”Ύ¬ΝΟΨΚœΫπ÷ ΝΩ”κ«β―θΗυ÷ ΝΩ÷°ΚΆΘ§Υυ“‘≥ΝΒμ÷–«β―θΗυΒΡ÷ ΝΩΈΣ![]() gΘ§Μρ’ΏΒ»”Ύ17bV
gΘ§Μρ’ΏΒ»”Ύ17bV![]() 10-3gΘ§Ι B¥μΈσΘΜ
10-3gΘ§Ι B¥μΈσΘΜ
CΓΔ«ΓΚΟ»ήΫβΚσ»ή“Κ÷–ΒΡ![]() άκΉ”ΒΡΈο÷ ΒΡΝΩΒ»”Ύ≥ΝΒμ÷ ΝΩΉν¥σ»ή“Κ÷–
άκΉ”ΒΡΈο÷ ΒΡΝΩΒ»”Ύ≥ΝΒμ÷ ΝΩΉν¥σ»ή“Κ÷–![]() άκΉ”ΒΡΈο÷ ΒΡΝΩΘ§Β±≥ΝΒμΝΩΉν¥σ ±Θ§»ή“Κ÷–ΒΡ»ή÷ ÷Μ”–œθΥαΡΤ
άκΉ”ΒΡΈο÷ ΒΡΝΩΘ§Β±≥ΝΒμΝΩΉν¥σ ±Θ§»ή“Κ÷–ΒΡ»ή÷ ÷Μ”–œθΥαΡΤ![]() Θ§œθΥαΗυάκΉ””κΡΤάκΉ”ΒΡΈο÷ ΒΡΝΩœύΒ»Θ§
Θ§œθΥαΗυάκΉ””κΡΤάκΉ”ΒΡΈο÷ ΒΡΝΩœύΒ»Θ§![]() Θ§Ι C’ΐ»ΖΘΜ
Θ§Ι C’ΐ»ΖΘΜ
DΓΔ≤ΈΦ”Ζ¥”ΠΒΡœθΥα”–ΝΫ÷÷Ής”ΟΘ§ΤπΥαΚΆ―θΜ·ΦΝΉς”ΟΘ§ΉςΈΣΥαΒΡœθΥα![]() …ζ≥…œθΥα―Έ
…ζ≥…œθΥα―Έ![]() ΒΡΈο÷ ΒΡΝΩΒ»”ΎœθΥαΡΤΒΡΈο÷ ΒΡΝΩΈΣ
ΒΡΈο÷ ΒΡΝΩΒ»”ΎœθΥαΡΤΒΡΈο÷ ΒΡΝΩΈΣ![]() Θ§Ής―θΜ·ΦΝΒΡœθΥαΒΡΈο÷ ΒΡΝΩΒ»”ΎNOΒΡΈο÷ ΒΡΝΩΈΣ
Θ§Ής―θΜ·ΦΝΒΡœθΥαΒΡΈο÷ ΒΡΝΩΒ»”ΎNOΒΡΈο÷ ΒΡΝΩΈΣ![]() Θ§Υυ“‘”κΚœΫπΖ¥”ΠΒΡœθΥαΒΡΈο÷ ΒΡΝΩΈΣ
Θ§Υυ“‘”κΚœΫπΖ¥”ΠΒΡœθΥαΒΡΈο÷ ΒΡΝΩΈΣ![]() Θ§Ι D’ΐ»ΖΓΘ
Θ§Ι D’ΐ»ΖΓΘ
¥πΑΗΘΚBΓΘ


 ΧλΧλΝΖΩΎΥψœΒΝ–¥πΑΗ
ΧλΧλΝΖΩΎΥψœΒΝ–¥πΑΗ
| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΈ“ΙζΩΤ―–»Υ‘±Χα≥ωΝΥ”…CO2 ΚΆ CH4 ΉΣΜ·ΈΣΗΏΗΫΦ”÷Β≤ζΤΖCH3COOH ΒΡ¥ΏΜ·Ζ¥”Πάζ≥Χ»γΆΦΥυ ΨΘΚ
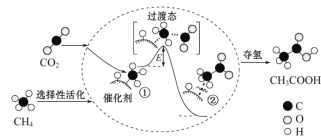
œ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «
A. ΗΟΖ¥”Π÷ΛΟς»ΈΚΈΖ«Ή‘ΖΔΖ¥”Π÷Μ“ΣΧθΦΰΚœ ΕΦΡήΫχ––
B. Ζ¥”ΠΙΐ≥Χ÷–Θ§÷Μ”–CΓΣH ΦϋΖΔ…ζΕœΝ―
C. Ή¥Χ§ΔΌΓΔΔΎ÷°ΦδΒΡΡήΝΩ≤νΦ¥ΗΟΖ¥”ΠΒΡλ ±δ
D. Κœ ΒΡ¥ΏΜ·ΦΝΩ…”––ßΫΒΒΆΜνΜ·Ρή
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΗυΨίœ¬Ν– Β―ιΘ§ΉήΫα±ΫΒΡΡ≥–©–‘÷ ΓΘ
(1)œρ ‘Ιή÷–Φ”»κ![]() ±ΫΘ§‘ΌΦ”»κ
±ΫΘ§‘ΌΦ”»κ![]() δεΥ°Θ§’ώΒ¥ΚσΨ≤÷ΟΓΘΙέ≤λΒΫΒΡœ÷œσ «________________________ΓΘ
δεΥ°Θ§’ώΒ¥ΚσΨ≤÷ΟΓΘΙέ≤λΒΫΒΡœ÷œσ «________________________ΓΘ
(2)œρ ‘Ιή÷–Φ”»κ![]() ±ΫΘ§‘ΌΦ”»κ
±ΫΘ§‘ΌΦ”»κ![]() Υα–‘ΗΏΟΧΥαΦΊ»ή“ΚΘ§’ώΒ¥ΚσΨ≤÷ΟΓΘΙέ≤λΒΫΒΡœ÷œσ «_________________________________________________________________________________________ΓΘ
Υα–‘ΗΏΟΧΥαΦΊ»ή“ΚΘ§’ώΒ¥ΚσΨ≤÷ΟΓΘΙέ≤λΒΫΒΡœ÷œσ «_________________________________________________________________________________________ΓΘ
(3) Β―ιΫα¬έΘΚ±Ϋ________(ΧνΓΑΡήΓ±ΜρΓΑ≤ΜΡήΓ±)”κδεΥ°ΚΆΥα–‘ΗΏΟΧΥαΦΊ»ή“ΚΖΔ…ζΖ¥”ΠΓΘ
(4)ΗυΨί…œ ω Β―ιΫα¬έΩ…÷ΣΘΚ±ΫΖ÷Ή”÷–________(ΧνΓΑ¥φ‘ΎΓ±ΜρΓΑ≤Μ¥φ‘ΎΓ±)ΧΦΧΦΥΪΦϋΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ“Μ–©ΨΜΥ°ΤςΆΤœζ…Χ‘ΎΆΤœζΤδ≤ζΤΖ ±Θ§Ϋχ––ΥυΈΫΒΡΓΑΒγΫβΥ°Ζ®Γ± Β―ιΘ§ΫΪ¥ΩΨΜΥ°”κΉ‘ά¥Υ°Ϋχ––Ε‘±»ΓΘΒ±ΒγΫβΉΑ÷Ο≤ε»κ¥ΩΨΜΥ°ΚΆΉ‘ά¥Υ°÷–Ά®Βγ ΐΖ÷÷”ΚσΘ§¥ΩΨΜΥ°―’…ΪΈό±δΜ·Μρ¬‘œ‘ΜΤ…ΪΘ§ΕχΉ‘ά¥Υ°»¥ΟΑ≥ωΤχ≈ί≤Δ…ζ≥…Μ“¬Χ…ΪΜρΚλΉΊ…ΪΒΡ≥ΝΒμΓΘΗυΨί…œ ωœ÷œσΘ§œ¬Ν–―ΓœνΥΒΖ®’ΐ»ΖΒΡ «Θ®ΓΓΓΓΘ©
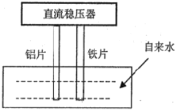
A.Ά®Βγ ±Θ§¬ΝΤ§Ήω―τΦΪΘ§ΧζΤ§Ήω“θΦΪ
B.…ζ≥…ΒΡΤχ≈ίΓΔΚλΉΊ…ΪΜρΜ“¬Χ…ΪΒΡ≥ΝΒμΕΦ «ΒγΫβΒΡ÷±Ϋ”ΜρΦδΫ”≤ζΈο
C.Ά®ΙΐΕ‘±»Θ§»Ζ ΒΡήΥΒΟςΉ‘ά¥Υ°÷–Κ§”–¥σΝΩΕ‘»ΥΧε”–ΕΨ”–ΚΠΒΡΈο÷
D.ΧζΤ§ΒΡΒγΦΪΖ¥”ΠΘΚO2+2H2O+4e-=4OH-
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΩ…ΡφΖ¥”ΠN2+3H2![]() 2NH3ΒΡ’ΐΓΔΡφΖ¥”ΠΥΌ¬ Ω…”ΟΗςΖ¥”ΠΈοΜρ…ζ≥…Έο≈®Ε»ΒΡ±δΜ·ά¥±μ ΨΓΘœ¬Ν–ΗςΙΊœΒ÷–ΡήΥΒΟςΖ¥”Π“―¥οΒΫΤΫΚβΉ¥Χ§ΒΡ «Θ® Θ©
2NH3ΒΡ’ΐΓΔΡφΖ¥”ΠΥΌ¬ Ω…”ΟΗςΖ¥”ΠΈοΜρ…ζ≥…Έο≈®Ε»ΒΡ±δΜ·ά¥±μ ΨΓΘœ¬Ν–ΗςΙΊœΒ÷–ΡήΥΒΟςΖ¥”Π“―¥οΒΫΤΫΚβΉ¥Χ§ΒΡ «Θ® Θ©
A.3v’ΐ(N2)=v’ΐ(H2)B.v’ΐ(N2)=vΡφ(NH3)
C.v’ΐ(N2)=3vΡφ(H2)D.2v’ΐ(H2)=3vΡφ(NH3)
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ“‘CΓΔCOΓΔCO2ΓΔCH4Β»Κ§1ΗωΧΦ‘≠Ή”ΒΡΈο÷ ΈΣ‘≠ΝœΘ§Ω…“‘Κœ≥…“Μ–©Μ·ΙΛ‘≠ΝœΚΆ»ΦΝœΓΘ
Θ®1Θ©ΧΦ‘≠Ή”ΒΡΚΥΆβΒγΉ”≈≈≤Φ Ϋ «___Θ§ΤδΉνΆβ≤ψ”–___÷÷‘ΥΕ·Ή¥Χ§≤ΜΆ§ΒΡΒγΉ”ΓΘ
Θ®2Θ©…œ ωΈο÷ ÷– τ”ΎΖ«ΦΪ–‘Ζ÷Ή”ΒΡ «___ΓΘ
Θ®3Θ©Κœ≥…ΤχΘ®COΚΆH2)‘Ύ≤ΜΆ§¥ΏΜ·ΦΝΒΡΉς”Οœ¬Θ§Ω…“‘Κœ≥…≤ΜΆ§ΒΡΈο÷ ΓΘ
ΔΌ”ΟΚœ≥…Τχ÷Τ±ΗΕΰΦΉΟ― ±Θ§ΜΙ≤ζ…ζΝΥ“Μ÷÷≥ΘΈ¬ΈΣ“ΚΧ§ΒΡ―θΜ·ΈοΘ§–¥≥ω÷Τ±ΗΕΰΦΉΟ―ΒΡΜ·―ßΖΫ≥Χ Ϋ____ΓΘ
ΔΎΫω”ΟΚœ≥…ΤχΈΣ‘≠Νœ≤ΜΩ…ΡήΚœ≥…ΒΡΈο÷ «___(ΧνΉ÷ΡΗ–ρΚ≈)ΓΘ
a.ΦΉ¥Φ b.““Εΰ¥Φ c.““ΕΰΥα d.ΡρΥΊ
ΙΛ“Β…œΩ…”ΟCO2…ζ≤ζ»ΦΝœΦΉ¥ΦΘΚCO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)+QΘ®Q>0Θ©ΓΘ‘Ύ2LΒΡΟή±’»ίΤς÷–Θ§ΖΔ…ζ…œ ωΖ¥”ΠΘΚ≤βΒΟn(CO2)ΚΆn(CH3OHΘ©Υφ ±Φδ±δΜ·»γΆΦΥυ ΨΓΘ
CH3OH(g)+H2O(g)+QΘ®Q>0Θ©ΓΘ‘Ύ2LΒΡΟή±’»ίΤς÷–Θ§ΖΔ…ζ…œ ωΖ¥”ΠΘΚ≤βΒΟn(CO2)ΚΆn(CH3OHΘ©Υφ ±Φδ±δΜ·»γΆΦΥυ ΨΓΘ

Θ®4Θ©ΗΟΖ¥”ΠΒΡΜ·―ßΤΫΚβ≥Θ ΐΒΡ±μ¥ο ΫK=___Θ§»γΙϊΤΫΚβ≥Θ ΐKΦθ–ΓΘ§ΤΫΚβ___(ΧνΓΑœρ’ΐΖ¥”ΠΖΫœρΓ±ΓΔΓΑœρΡφΖ¥”ΠΖΫœρΓ±ΜρΓΑ≤ΜΓ±)“ΤΕ·ΓΘ
Θ®5Θ©¥”Ζ¥”ΠΩΣ ΦΒΫΤΫΚβΘ§H2ΒΡΤΫΨυΖ¥”ΠΥΌ¬ vΘ®H2Θ©=___ΓΘ
Θ®6Θ©ΈΣΝΥΧαΗΏCH3OHΒΡ≤ζΝΩΘ§άμ¬έ…œΩ…“‘≤…»ΓΒΡΚœάμ¥κ ©”–___ΓΔ___Θ®»Έ–¥2Χθ¥κ ©Θ©ΓΘ
Θ®7Θ©≥ΘΈ¬≥Θ―Ιœ¬Θ§16g“ΚΧ§ΦΉ¥ΦΆξ»Ϊ»Φ…’Θ§Β±Μ÷Η¥ΒΫ‘≠Ή¥Χ§ ±Θ§Ζ≈≥ω369.2kJΒΡ»»ΝΩΘ§–¥≥ωΗΟΖ¥”ΠΒΡ»»Μ·―ßΖΫ≥Χ Ϋ___ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬Ν–ΙΊ”ΎΦέΒγΉ”≈≈≤Φ ΫΈΣ3s23p4ΒΡΝΘΉ”ΒΡΟη ω’ΐ»ΖΒΡ «(ΓΓΓΓ)
A. ΥϋΒΡ‘≠Ή”ΚΥΆβ”–»ΐ÷÷–ΈΉ¥≤ΜΆ§ΒΡΒγΉ”‘Τ
B. ΥϋΒΡ‘≠Ή”ΚΥΆβΒγΉ”Ι≤”–16÷÷≤ΜΆ§ΒΡ‘ΥΕ·Ή¥Χ§
C. ΥϋΩ…”κH2Ζ¥”Π…ζ≥…≥ΘΈ¬ ±ΒΡ“ΚΧ§Μ·ΚœΈο
D. ΗΟ‘≠Ή”ΒΡΙλΒά±μ Ψ ΫΈΣ![]()
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬±μΗςΉιΈο÷ ÷°ΦδΆ®Ιΐ“Μ≤ΫΖ¥”Π≤ΜΩ…“‘ Βœ÷»γœ¬ΆΦΥυ ΨΉΣΜ·ΙΊœΒΒΡ «

―Γœν | X | Y | Z | ΦΐΆΖ…œΥυ±ξ ΐΉ÷ΒΡΖ¥”ΠΧθΦΰ |
A | SiO2 | Na2SiO3 | H2SiO3 | ΔΌ”κNa2CO3»έ»Ύ |
B | NaCl | NaHCO3 | Na2CO3 | ΔΎΦ”»» |
C | N2 | NO2 | HNO3 | ΔέΦ”»» |
D | C | CO | CO2 | ΔήΉΤ»»ΧΩΖέ |
A. A B. B C. C D. D
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ“―÷Σ: 25ΓφΓΔ101 kPaœ¬ΘΚΔΌ 2 Na(s) + 1/2 O2(g) = Na2O(s) ΓςH1 = - 414 kJ / mol
ΔΎ 2 Na(s) + O2(g) = Na2O2(s) ΓςH2 = - 511 kJ / mol
œ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «
A. ΔΌΚΆΔΎ≤ζΈοΒΡ“θ―τάκΉ”Ηω ΐ±»≤ΜœύΒ»
B. ΔΌΚΆΔΎ…ζ≥…Β»Έο÷ ΒΡΝΩΒΡ≤ζΈοΘ§ΉΣ“ΤΒγΉ” ΐ≤ΜΆ§
C. ≥ΘΈ¬œ¬Na”κΉψΝΩO2Ζ¥”Π…ζ≥…Na2OΘ§ΥφΈ¬Ε»…ΐΗΏ…ζ≥…Na2OΒΡΥΌ¬ ÷πΫΞΦ”Ωλ
D. 25ΓφΓΔ101 kPaœ¬Θ§Na2O2(s) + 2 Na(s) = 2 Na2O(s) ΓςH = -317 kJ / mol
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΙζΦ ―ß–Θ”≈―Γ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com