
 2NO(g) DH=a kJ·mol-1的平衡常数K如下表:
2NO(g) DH=a kJ·mol-1的平衡常数K如下表:| 温度/℃ | 1538 | 1760 | 2404 |
| 平衡常数K | 0.86×10-4 | 2.6×10-4 | 64×10-4 |
 2NO(g)达到平衡时N2的浓度为 。(此温度下不考虑O2与NO的反应。计算结果保留两位有效数字)
2NO(g)达到平衡时N2的浓度为 。(此温度下不考虑O2与NO的反应。计算结果保留两位有效数字) 2NO(g)
2NO(g)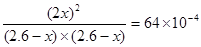
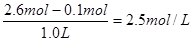
 2NO(g) DH=a kJ·mol-1和反应②2N2(g)+6H2O(1)=4NH3 (g)+3O2(g) DH=+1530kJ·mol-1叠加,即①×2-②得到4NH3(g)+5O2(g)=4NO(g)+6H2O(1),所以其反应热是(2a-1530)kJ·mol-。
2NO(g) DH=a kJ·mol-1和反应②2N2(g)+6H2O(1)=4NH3 (g)+3O2(g) DH=+1530kJ·mol-1叠加,即①×2-②得到4NH3(g)+5O2(g)=4NO(g)+6H2O(1),所以其反应热是(2a-1530)kJ·mol-。

科目:高中化学 来源:不详 题型:单选题
| A.H2O(g) = H2(g)+1/2 O2(g)△H=+286kJ·mol-1 |
| B.2H2(g)+ O2(g)=2H2O(l)△H=-572kJ·mol-1 |
| C.H2(g)+ 1/2O2(g)= H2O(g)△H=-286kJ·mol-1 |
| D.H2(g)+1/2 O2(g)=H2O(l)△H=+286 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.196.46 kJ | B.55.175 kJ |
| C.141.285 kJ | D.282.57 kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
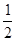 O2(g) = H2O(g) ΔH1=a kJ·mol-1?
O2(g) = H2O(g) ΔH1=a kJ·mol-1?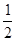 O2(g) = H2O(l) ΔH2=b kJ·mol-1??
O2(g) = H2O(l) ΔH2=b kJ·mol-1??| 化学键 | H-H | N-H | N≡N |
| 键能/kJ·mol-1 | 436 | 391 | 945 |
 2NH3(g) △H=a kJ·mol-1。试根据表中所列键能数据估算a 的值: (写出 + 或-)。
2NH3(g) △H=a kJ·mol-1。试根据表中所列键能数据估算a 的值: (写出 + 或-)。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 (g)+1/2O
(g)+1/2O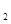 (g)=CO(g)+2H
(g)=CO(g)+2H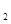 (g)
(g)  H1=-35.6kJ·mol
H1=-35.6kJ·mol
 (g)+2O
(g)+2O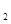 (g)=CO2(g)+2H2O(g)
(g)=CO2(g)+2H2O(g)  H2=-890.3kJ·mol
H2=-890.3kJ·mol
 (g)+CO
(g)+CO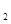 (g)=2CO(g)+2H
(g)=2CO(g)+2H (g)
(g)  H3=247.3kJ·mol
H3=247.3kJ·mol
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/( mol ·/L-1) | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
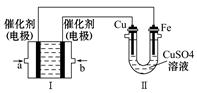
 的物质的量浓度 。
的物质的量浓度 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.─484KJ/moL | B.+484KJ/moL | C.─242KJ/moL | D.+242KJ/moL |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.吸热反应 | B.放热反应 | C.放出832 kJ热量 | D.吸收183 kJ热量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com