
【题目】常温下,0.2 mol·L-1的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是

A. HA为强酸
B. 该混合液pH=7
C. 图中X表示HA,Y表示OH-,Z表示H+
D. 该混合溶液中:c(A-)+c(Y)=0.1
【答案】D
【解析】
一元酸HA和NaOH溶液等体积、等浓度0.2mol/L混合,HA+NaOH=NaA+H2O,所得溶液中A-浓度小于0.1mol/L,说明在溶液中存在A-+H2OHA+OH-,NaA水解,HA为弱酸,NaA溶液呈碱性,则c(OH-)>c(H+),一般来说,盐类的水解程度较低,则有c(A-)>c(OH-),所以有:c(Na+)=0.1mol/L>c(A-)>c(OH-)>c(HA)>c(H+),即X表示OH-,Y表示HA,Z表示H+,溶液中存在物料守恒为:c(Na+)=c(A-)+c(HA)。
A.HA为弱酸;B.该混合液pH>7;C.X表示OH-,Y表示HA,Z表示H+;D.Y表示HA,溶液中存在物料守恒得到c(A-)+c(Y)=c(Na+)。
一元酸HA和NaOH溶液等体积、等浓度0.2mol/L混合,HA+NaOH=NaA+H2O,所得溶液中A-浓度小于0.1mol/L,说明在溶液中存在A-+H2OHA+OH-,NaA水解,HA为弱酸,NaA溶液呈碱性,则c(OH-)>c(H+),一般来说,盐类的水解程度较低,则有c(A-)>c(OH-),所以有:c(Na+)=0.1mol/L>c(A-)>c(OH-)>c(HA)>c(H+),即X表示OH-,Y表示HA,Z表示H+,溶液中存在物料守恒得到:c(Na+)=c(A-)+c(HA),
A.一元酸HA和NaOH溶液等体积、等浓度0.2mol/L混合,二者恰好反应:HA+NaOH=NaA+H2O,所得溶液为NaA溶液,溶液中中A-浓度小于0.1mol/L,说明在溶液中存在A-+H2OHA+OH-,NaA水解,HA为弱酸,选项A错误;
B.c(Na+)>c(A-),说明NaA发生水 A-+H2OHA+OH-,该混合液的pH>7,选项B错误;
C.HA是弱电解质,则有c(A-)>c(OH-),c(OH-)除了水解产生的还有水电离的,因此c(OH-)>c(HA),所以有:c(Na+)=0.1mol/L>c(A-)>c(OH-)>c(HA)>c(H+),即X表示OH-,Y表示HA,Z表示H+,选项C错误;
D.溶液中存在物料守恒c(Na+)=c(A-)+c(HA),Y表示HA,得到c(A-)+c(Y)=c(Na+)=0.1mol/L,选项D正确;
答案选D。


 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数,下列说法正确的是
A. 1L1mol/LMgCl2溶液中含有的Mg2+离子数为NA
B. 100 mL 2.0 mol/L的盐酸与醋酸溶液中氢离子均为0.2NA
C. 0.1mol/L稀硫酸中含SO42- 的数目为0.1NA
D. 标准状况下,11.2LNO和5.6LO2混合后,分子总数小于0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物浆液含Al(OH)3、MnO2和少量Na2CrO4。考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图2),使浆液分离成固体混合物和含铬元素溶液,并回收利用。回答Ⅰ和Ⅱ中的问题。

Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)
(1)反应①所加试剂NaOH的电子式为_________,B→C的反应条件为__________,C→Al的制备方法称为______________。
(2)该小组探究反应②发生的条件。D与浓盐酸混合,不加热,无变化;加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2。由此判断影响该反应有效进行的因素有(填序号)___________。
a.温度 b.Cl-的浓度 c.溶液的酸度
(3)0.1 mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2·xH2O的液态化合物,放热4.28 kJ,该反应的热化学方程式为__________。
Ⅱ.含铬元素溶液的分离和利用
(4)用惰性电极电解时,CrO42-能从浆液中分离出来的原因是__________,分离后含铬元素的粒子是_________;阴极室生成的物质为___________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值。下列说法不正确的是( )
A.H2SO4的摩尔质量以g·mol-1为单位时,与NA个硫酸分子的质量以g为单位时在数值上相等
B.NA个氧气分子和NA个氮气分子的质量比为8∶7
C.常温常压下,2.86gNa2CO3·10H2O含有的Na+个数为0.02NA
D.物质的量浓度为0.5mol/L的CaCl2溶液中,含有的Cl-个数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.通常状况下,NA个CO2分子占有的体积约为22.4L
B.1mol·L-1Na2SO4溶液中所含Na+的数目为2NA
C.40gNaOH溶解在1L水中,则其100mL溶液中含Na+数为0.1NA
D.14g氮气中含有7NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 增加固体反应物的质量,反应速率一定加快
B. 镁与稀盐酸反应时,加入适量的氯化钾溶液,生成氢气的速率不变
C. 对于可逆反应,升高反应体系温度,正反应速率和逆反应速率均增加
D. A(g)+B(g)![]() C(g)+D(g),恒温恒容充入 He 以增大压强,化学反应速率加快
C(g)+D(g),恒温恒容充入 He 以增大压强,化学反应速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的的是(夹持装置未画出)
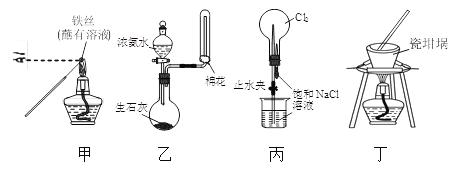
A. 用装置甲检验溶液中是否有K+
B. 用装置乙制取并收集少量NH3
C. 用装置丙进行喷泉实验
D. 用装置丁加热熔融NaOH固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)浓硫酸与木炭粉加热反应的化学方程式为:________________。
(2)试用下图中所列各装置设计一个实验,验证上述反应所产生的各种产物。这种装置的连接顺序(按产物气流从左到右的方向)是(填图中装置的编号):_______→________→________→________。
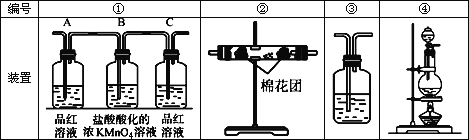
(3)实验时可观察到装置①中,A瓶的溶液褪色,C瓶的溶液不褪色。
A瓶溶液的作用是:___________________________________,
B瓶溶液的作用是_____________________________________,
C瓶溶液的作用是_____________________________________。
(4)装置②中所加的白色固体药品是_____________,可验证的产物是____________。
(5)装置③中所盛的溶液是__________________,可验证的产物是_____________。
(6)在各装置所盛的试剂不变的条件下,若装置的连接顺序为④→①→②→③,则可以检出的产物是_______________填化学式,下同),不能检出的产物是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列各组化合物中,化学键类型和化合物类型均相同的是_________(填序号)。
①CaCl2和 Na2S ②Na2O 和 Na2O2 ③CO2和CaO ④HCl 和 NaOH
(2)下列过程不一定释放能量的是________。
①化合反应;②分解反应;③形成化学键;④燃料燃烧;⑤酸碱中和;⑥炸药爆炸
(3)Ba(OH)2 8H2O和NH4Cl反应的化学方程式是________________________________,反应过程能量变化的图像符合_____________(填“图1”或“图2”)。

图1 图2
(4)已知1 mol石墨转化为1 mol金刚石要吸收能量,则石墨比金刚石_______(填“稳定”或“不稳定”)。
(5)一定量的氢气在氧气中充分燃烧并放出热量。若生成气态水放出的热量为Q1,生成液态水放出的热量为Q2,那么Q1______Q2(填大于、小于或等于)。
(6)已知:4HCl+O2=2Cl2+2H2O。该反应中,4 mol HCl被氧化,放出115.6 kJ的热量,且断开O=O键和Cl-Cl键所需的能量如下图所示。则断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为______ kJ。
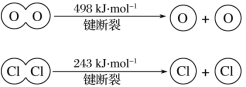
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com