
【题目】用下图甲所示装置电解饱和食盐水制Cl2、H2和NaOH。
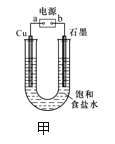
(1)b为电源的______极,Cu极的电极反应式为________。
(2)某同学在进行上述实验时,发现铜电极下方产生红色沉淀,石墨电极上产生无色无味的气体,则该同学将石墨连接到了电源的______极。
(3)电解粗铜制精铜时,可采用NO2、O2和熔融NaNO3制作的燃料电池作电源,其原理如图,该电池在使用过程中石墨 I电极上生成氧化物Y,则其正极的电极反应为:__________。
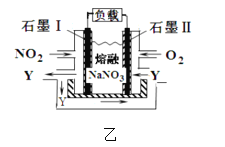
【答案】正 2H++2e-=H2 ↑ 负 O2+4e-+2N2O5=4NO3-
【解析】
根据电解池原理分析电解饱和食盐水时所用电极及对应的电极反应;根据燃料电池原理书写电极反应式。
(1)用惰性电极电解饱和食盐水时,在阳极上产生氯气,在阴极上产生氢气和氢氧化钠,此时阳极是惰性电极,即b为电源的正极,Cu作阴极,发生还原反应,电极反应式为: 2H++2e-=H2 ↑;
(2)发现铜电极下方产生红色沉淀,则金属铜是阳极,a为电源的正极,石墨连接到了电源的负极,阳极的电极反应式为:2OH-+2Cu-2e-=Cu2O↓+H2O,故答案为负极;
(3)根据燃料电池的构造得总反应为4NO2 + O2 = 2N2O5,氧化物Y为N2O5,正极得电子,发生还原反应,则电极反应为:O2+4e-+2N2O5=4NO3-。


 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】已知A、B、C、D和E五种分子所含原子的数目依次为1、2、3、4和6,且都含有18个电子,又知B、C和D是由两种元素的原子组成,且D分子中两种原子个数比为1:1。请回答:
(1)组成A分子的原子的核外电子排布式是________________;
(2)B的分子式分别是 ___________;C分子的立体结构呈_________ 形,该分子属于_____________分子(填“极性”或“非极性”);
(3)向D的稀溶液中加入少量氯化铁溶液,反应的化学方程式为_____________________________
(4) 若将1molE在氧气中完全燃烧,只生成1molCO2和2molH2O,则E的分子式是 __________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟氨(NH2OH )为一元弱碱 (25℃时 ,电离常数 Kb=9.0×l0-9), 其电离方程式为:NH2OH+H2O![]() NH3OH+ +OH-。用 0.lmol/L 盐酸滴定 20mL0.l mol/L NH2OH 溶液,恒定 25℃时, 滴定过程中由水电离出来OH-浓度的负对数与盐酸体积的关系如图所示(已知:lg3=0.5) 。 下列说法正确的是
NH3OH+ +OH-。用 0.lmol/L 盐酸滴定 20mL0.l mol/L NH2OH 溶液,恒定 25℃时, 滴定过程中由水电离出来OH-浓度的负对数与盐酸体积的关系如图所示(已知:lg3=0.5) 。 下列说法正确的是
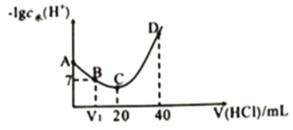
A.A、B、C、D 四点对应的溶液中 NH2OH 电离常数不相等
B.A 点对应溶液的 pH=8.5
C.D点对应溶液中存在:c(H+)=c(OH-)+c(NH3OH+)+c(NH2OH)
D.B点时溶液呈中性,C 点时溶液呈酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学用图所示装置制取氨,并探究其性质。
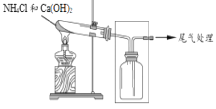
(1)制取氨气的化学方程式是______。
(2)采用图示的方法收集氨气,是因为氨气的密度比空气 ______(填“大”或“小”)。
(3)将蘸有浓盐酸的棉球放在玻璃片上,用集满NH3的集气瓶扣住棉球,可观察到的现象是______。
(4)甲同学设计了下图所示的装置进行尾气处理,乙同学认为该设计不合理,请画出正确的尾气吸收图______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,体积均为25.00mL,浓度均为0.0100mo1L-1的HA、H3B溶液分别用0.0100mo1L-1NaOH溶液滴定,溶液的pH随V(NaOH)变化曲线如图所示,下列说法正确的是( )
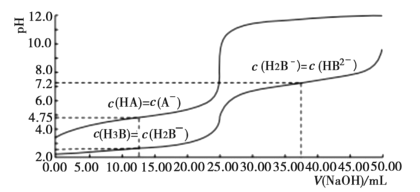
A.25℃时,0.0100mo1L-1Na2HB溶液的pH>7
B.向HA溶液中滴加NaOH溶液至中性,c(A-)<c(HA)
C.NaOH溶液滴定HA溶液应选甲基橙作指示剂
D.25℃时,H2B-离子的水解常数的数量级为10-3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校学生用如图所示装置进行实验,以探究苯与溴发生反应的原理并分离提纯反应的产物。请回答下列问题:

(1)装置(Ⅱ)中发生反应的化学方程式为 2Fe+3Br2 ═2FeBr3、________ 。
(2)实验开始时,关闭 K2、开启 K1和分液漏斗活塞,滴加苯和液溴的混合液, Ⅲ中小试管内苯的作用是___________。
(3)能说明苯与液溴发生了取代反应的现象是___________。
(4)反应结束后,要让装置I中的水倒吸入装置Ⅱ中,这样操作的目的是___________。简述这一操作的方法:___________ 。
(5)四个实验装置中能起到防倒吸作用的装置有___________。
(6)将装置(Ⅱ)反应后的液体依次进行下列实验操作就可得到较纯净的溴苯。
①用蒸馏水洗涤,振荡,分液; ②用5%的NaOH溶液洗涤,振荡,分液;
③用蒸馏水洗涤,振荡,分液; ④加入无水CaCl2粉末干燥;⑤________(填操作名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列物质:①He;②N2;③H2O2;④CaO;⑤NaHCO3;⑥NH4Cl;⑦Na2O2;⑧SiO2;⑨MgCl2;⑩KOH。请用序号填空:
(1)只含离子键的物质是______________;
(2)只含共价键的物质是______________;
(3)既含离子键又含共价键的物质是______________;
(4)只含极性键的物质是______________;
(5)既含离子键又含非极性键的物质是______________;
(6)不存在化学键的物质是______________;
(7)属于离子化合物的是______________;
(8)属于共价化合物的是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种黄绿色气体,易溶于水,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。回答下列问题:
(1)在处理废水时,ClO2可将废水中的CN-氧化成CO2和N2,该反应的离子方程式是_______。
(2)某小组按照文献中制备ClO2的方法设计了如图所示的实验装置用于制备ClO2。
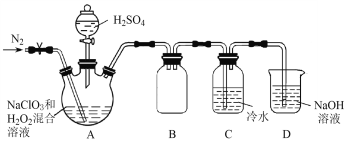
①通入氮气的主要作用有2个,一是可以起到搅拌作用,二是____________________。
②装置B的作用是__________________。
③装置A用于生成ClO2气体,该反应的化学方程式是_______________________________。
(3)测定装置C中ClO2溶液的浓度:取10.00 mL C中溶液于锥形瓶中,加入足量的KI溶液和H2SO4酸化,然后加入___________________作指示剂,用0.100 0 mol![]() L-1的Na2S2O3标准液滴定锥形瓶中的溶液(I2 + 2S2O32-=2I-+ S4O62-),消耗标准溶液的体积为20.00 mL。滴定终点的现象是______________________________,C中ClO2溶液的浓度是__________mol
L-1的Na2S2O3标准液滴定锥形瓶中的溶液(I2 + 2S2O32-=2I-+ S4O62-),消耗标准溶液的体积为20.00 mL。滴定终点的现象是______________________________,C中ClO2溶液的浓度是__________mol![]() L-1。
L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示用酸性氢氧燃料电池为电源进行的电解实验。下列说法中正确的是( )
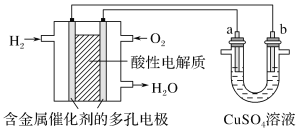
A. 燃料电池工作时,正极反应为:O2+2H2O+4e-=4OH-
B. a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出
C. a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
D. a、b两极均是石墨时,a极上产生的O2与电池中消耗的 H2体积比为 ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com