
【题目】下列实验方案能到实验目的的是( )
A.制备纯净干燥的Cl2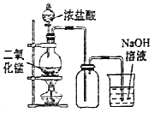
B.证明锌比铜活泼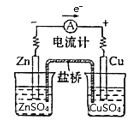
C.制备无水氯化亚铁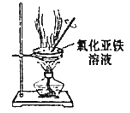
D.证明一水合氨是一元碱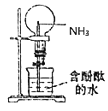
科目:高中化学 来源: 题型:
【题目】某温度下,重水( D2O)的离子积常数为1.6×10-15,若用定义pH一样规定pD= -lgc(D+),则在该温度下,下列叙述正确的是
A. 纯净的重水中,c(D+) ·c(OD-)>1.0×10-14
B. l L溶解有0.01 mol DCl的重水溶液,其pD=2
C. 1 L溶解有0. 01 mol NaOD的重水溶液,其pD=12
D. 纯净的重水中,pD=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作正确的是______.
A.使用冷凝管时,应使冷却液与被冷却的物质流动方向相同;
B.盛过苯酚的试管可以用NaOH溶液清洗,若皮肤上沾有苯酚,应立即用酒精洗涤;
C.用![]() 的硫酸和无水乙醇加热至
的硫酸和无水乙醇加热至![]() ,可以制取乙烯;
,可以制取乙烯;
D.除去苯中的少量苯酚,可加入适量的浓溴水后再过滤;
E.分馏原油实验中,温度计的下端不插入原油中;
F.碳化钙是块状固体,但实验室中不用启普发生器制乙炔;
G.将苯与溴水混合后加铁屑可制取溴苯;
H.将溴乙烷与NaOH溶液共热几分钟后冷却,滴入![]() 溶液,观察沉淀颜色,可用来检验溴乙烷中溴元素的存在.
溶液,观察沉淀颜色,可用来检验溴乙烷中溴元素的存在.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.12g金刚石中含有的共价键数为4NA
B.7g超重甲基(—CT3)中含有的电子数为3NA
C.标准状况下,22.4L氩气中含有的原子数约为2NA
D.0.1molNa2O2与SO2完全反应转的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关叙述正确的是
A. 向0.1 mol·L1 Na2CO3溶液中通入适量CO2气体后:c(Na+)=2[c(![]() )+c(
)+c(![]() )+c(H2CO3)]
)+c(H2CO3)]
B. 常温下,pH=6的NaHSO3溶液中:c(![]() )c(H2SO3)=9.9×107 mol·L1
)c(H2SO3)=9.9×107 mol·L1
C. 等物质的量浓度、等体积的Na2CO3和NaHCO3混合:![]() <
<![]()
D. 0.1 mol·L1 Na2C2O4溶液与0.1 mol·L1 HCl溶液等体积混合(H2C2O4为二元弱酸):2c(![]() )+c(
)+c(![]() )+c(OH)=c(Na+)+c(H+)
)+c(OH)=c(Na+)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等物质的量的X(g)与Y(g)在密闭容器中进行可逆反应:X(g)+Y(g) ![]() 2Z(g)+W(s) ΔH<0,下列叙述正确的是 ( )
2Z(g)+W(s) ΔH<0,下列叙述正确的是 ( )
A. 平衡常数K值越大,X的转化率越大
B. 达到平衡时,反应速率v正(X)=2v逆(Z)
C. 达到平衡后降低温度,正向反应速率减小的倍数大于逆向反应速率减小的倍数
D. 达到平衡后,升高温度或增大压强都有利于该反应平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铝土矿(主要成分为![]() )为原料冶炼金属铝,主要步骤包括:①将粉碎后的铝土矿溶解在氢氧化钠溶液中;②向①的所得溶液中通入过量二氧化碳,获得氢氧化铝固体;③使氢氧化铝脱水生成氧化铝;④……
)为原料冶炼金属铝,主要步骤包括:①将粉碎后的铝土矿溶解在氢氧化钠溶液中;②向①的所得溶液中通入过量二氧化碳,获得氢氧化铝固体;③使氢氧化铝脱水生成氧化铝;④……
(1)步骤④为冶炼金属铝的过程,应选择的方法是______(填序号)。
A.以C、![]() 或
或![]() 作还原剂 B.热分解法 C.利用铝热反应原理还原 D.电解法
作还原剂 B.热分解法 C.利用铝热反应原理还原 D.电解法
(2)步骤③所涉及反应的化学方程式为_____________________________________________。
(3)步骤①所涉及反应的离子方程式为_________________________________________________。
(4)步骤②至步骤③的过程中,须经过_____操作。
(5)步骤②所得溶液中含有的大量阴离子是________________(填离子符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,一定条件下进行如下反应:CO2(g)+H2(g)![]() CO(g)+H2O(g) △>0,达到平衡后,为提高该反应的速率和CO2的转化率,采取的正确措施是( )
CO(g)+H2O(g) △>0,达到平衡后,为提高该反应的速率和CO2的转化率,采取的正确措施是( )
A.加催化剂B.升高温度C.充入CO2D.降低压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 为二元弱酸,
为二元弱酸,![]() ,
,![]() ,设
,设![]() 溶液中
溶液中![]() 。室温下用NaOH溶液滴定
。室温下用NaOH溶液滴定![]() 溶液至终点。滴定过程得到的下列溶液中微粒的物质的量浓度关系一定正确的是( )
溶液至终点。滴定过程得到的下列溶液中微粒的物质的量浓度关系一定正确的是( )
A.![]() 溶液:
溶液:![]()
B.![]() 的溶液:
的溶液:![]()
C.![]() 的溶液:
的溶液:![]()
D.![]() 的溶液:
的溶液:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com