
【题目】(i)燃料电池是目前正在探索的一种新型电池,目前已经使用的氢氧燃料电池的基本反应是正极:O2+2H2O+4e-=4OH-,回答下列问题:
(1)电解质溶液为____________。
(2)负极发生________反应(填“氧化”或“还原”)。写出其电极反应式___________。
(3)若反应后得到5.4 g液态水,此时氢氧燃料电池转移的电子数为________。
(ii)如图所示的装置,在盛有水的烧杯中,铁圈和银圈的连接处吊着一根绝缘的细丝,使之平衡。小心地往烧杯中央滴入CuSO4溶液。

(1)片刻后可观察到的现象是(指悬吊的金属圈)________。
A.铁圈和银圈左右摇摆不定 B.保持平衡状态不变
C.铁圈向下倾斜 D.银圈向下倾斜
(2)产生上述现象的原因是___________________________________。
(iii)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式:___________________________。
(2)若将(1)中的反应设计成原电池,并写出正、负极电极反应式。
正极反应:______________________,负极反应:______________________。
【答案】 KOH 氧化 H2+2OH--2e-===2H2O 0.6NA D 加入CuSO4溶液后,构成Fe-Ag原电池,铁溶解,质量减轻,Cu2+在银圈上得电子,生成Cu沉积在其上,质量增加 2Fe3++Cu===2Fe2++Cu2+ 2Fe3++2e-===2Fe2+ Cu-2e-===Cu2+
【解析】分析:(i)根据正极产生氢氧根判断电解质溶液的酸碱性;根据原电池的工作原理解答;根据总反应式计算转移电子数;
(ii)小心地往烧杯中央滴入CuSO4溶液后构成原电池,结合原电池的工作原理解答。
(iii)(1)FeCl3溶液与铜反应生成氯化亚铁和氯化铜;
(2)根据原电池的工作原理结合铁离子和铜的性质解答。
详解:(1)氢氧燃料电池的正极反应式为O2+2H2O+4e-=4OH-,正极产生氢氧根,这说明电解质溶液为碱性溶液,例如KOH。
(2)原电池的负极发生失去电子的氧化反应,则负极发生氧化反应,因此氢气在负极通入,则其电极反应式为H2+2OH--2e-=2H2O;
(3)总反应式为O2+2H2=2H2O,即生成36g水转移4mol电子,因此若反应后得到5.4 g液态水,则此时氢氧燃料电池转移的电子数为![]() =0.6NA。
=0.6NA。
(ii)(1)小心地往烧杯中央滴入CuSO4溶液后构成原电池,金属性铁大于银,因此铁是负极,失去电子转化为亚铁离子,质量减小。溶液中的铜离子在正极银电极表面放电析出铜,质量增加,所以片刻后可观察到的现象是银圈向下倾斜,答案选D;
(2)根据以上分析可知产生上述现象的原因是加入CuSO4溶液后,构成Fe-Ag原电池,铁溶解,质量减轻,Cu2+在银圈上得电子,生成Cu沉积在其上,质量增加。
(iii)(1)FeCl3溶液与铜反应生成氯化亚铁和氯化铜,反应的方程式为2Fe3++Cu=2Fe2++Cu2+;
(2)根据方程式可知铜失去电子,则铜是负极,电极反应式为Cu-2e-=Cu2+。溶液中的铁离子得到电子,在正极放电,则正极反应为2Fe3++2e-=2Fe2+。


 一课一练课时达标系列答案
一课一练课时达标系列答案 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
【题目】已知A、B、C、D为气体,其中A为黄绿色,D极易溶于水,形成的溶液可使酚酞变红,它们之间的转化关系如下图①所示:

(1)将气体B点燃,把导管伸入盛满气体A的集气瓶,反应过程中的实验现象有______________(填序号)
①放热 ②黄绿色褪去 ③瓶口有白雾 ④瓶口有白烟
⑤安静燃烧,发出黄色火焰 ⑥安静燃烧,发出苍白色火焰
(2)实验室制D的化学方程式为:_______________________________________。
(3)实验室可用如上图②所示装置收集D,下列叙述正确的是__________(填序号)
①D气体不能用排水法收集 ② 干燥管里盛有碱石灰
③ 图②中的a为棉花团,其作用是防止收集的气体逸出
(4)气体D催化氧化的化学方程式为:______________________________。
(5)物质E的化学式是_____________;E在下列物质分类中所属的物质种类是____________________________(填序号)。
①电解质 ②化合物 ③混合物 ④纯净物 ⑤非电解质 ⑥盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中有取之不尽的化学资源,从海水中可提取多种化工原料。如图是某工厂综合利用海水资源的示意图。

试回答下列问题:
(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制后可得饱和NaCl溶液。精制过程中所用试剂有a、BaCl2溶液、b、Na2CO3溶液、c、 NaOH溶液、d、盐酸。加入试剂顺序正确的是____________;
A、a.b.c.d B、c.b.a.d C、b.a.d.c D、a.c.b.d
(2)写出电解饱和食盐水方程式________________________________________,产生的Cl2和烧碱反应能生成____________(填商品名称),反应方程式________。
(3)海水中提取食盐后的母液中含有K+、Na+、Mg2+等。从离子反应的角度考虑,向母液中加入石灰乳的作用是_________________________。
(4)电解熔融的氯化镁所得的镁蒸气冷却后即为固体镁,可以冷却镁蒸气的气体氛围为_____。
A.H2 B.CO2 C.空气 D.Ar
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无色透明的酸性溶液中能大量共存的离子组是
A.K+、HCO3-、Cl-B.Fe2+、Cu2+、SO42-
C.Na+、SO42-、ClO-D.Mg2+、NH4+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温下,将a mol N2和b mol H2按一定比例混合,在相同状况下其密度是H2的 3.6倍,取5mol该混合气体通入密闭容器内,使之发生反应并在一定条件下达到平衡。已知反应达到平衡后容器内压强是相同条件下反应前压强的0.92倍,试求:
(1)反应前混合气体中N2和 H2的体积比a﹕b=__________;
(2)达到平衡时混合气体中的H2、NH3的物质的量分别是_____mol、_____mol;
(3)平衡时N2的转化率[n转化(N2)与n初始(N2)之比]________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中正确的是( )
A.将SO2气体通入NaClO溶液中:SO2+2ClO﹣+H2O═SO32﹣+2HClO
B.向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2﹣+CO2+2H2O═Al(OH)3↓+HCO3﹣
C.向Na2S2O3溶液中通入足量氯气:S2O32﹣+2Cl2+3H2O═2SO32﹣+4Cl﹣+6H+
D.电解饱和MgCl2溶液:2Cl﹣+2H2O ![]() 2OH﹣+H2↑+Cl2↑
2OH﹣+H2↑+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应:X2(g)+Y2(g)2Z(g),已知X2、Y2、Z起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度可能是( )
A.c(Z)=0.4 mol/L
B.c(X2)=0.2mol/L
C.c(Y2)=0.4mol/L
D.c(X2)+c(Y2)+c(Z)=0.6mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生以铁丝和Cl2为原料进行下列三个实验.从分类角度分析,下列选项正确的是( ) 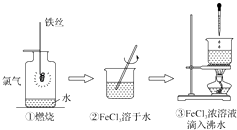
A.实验①、②所涉及的物质均为电解质
B.实验②、③均为放热反应实验
C.②、③均未发生氧化还原反应
D.实验①、③反应制得的物质均为纯净物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com