
【题目】下列物质中既含有共价键又含有离子键的是( )
A.NaI
B.CaCl2
C.CO2
D.KOH
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】对下列图像的描述正确的是
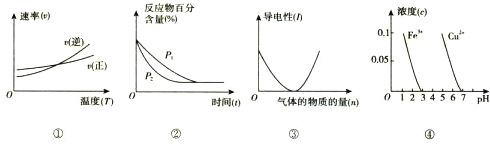
A. 根据图①判断反应A2(g)+3B2(g) ![]() 2AB3(g)的 △H>0
2AB3(g)的 △H>0
B. 图②可表示压强(P)对反应2A(g)+2B(g) ![]() 3C(g)+D(s)的影响
3C(g)+D(s)的影响
C. 图③可表示向醋酸溶液通入氨气时,溶液导电性随氨气量的变化
D. 根据图④,除去CuSO4溶液中的Fe3+,可加入CuO调节pH至3~5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铅蓄电池电解甲、乙电解池中的溶液。己知铅蓄电池的总反应为:Pb(s)+PbO2(s)+2H2SO4(aq)![]() 2PbSO4(s)+2H2O(l)电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )
2PbSO4(s)+2H2O(l)电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )
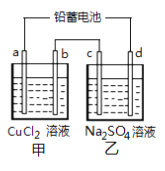
A. d极为阴极
B. 放电时铅蓄电池负极的电极反应式为:PbO2(s)+4H+(aq)+SO42-(aq)+4e-=PbSO4(s)+2H2O(l)
C. 若利用甲池精炼铜,b极应为粗铜
D. 若四个电极材料均为石墨,当析出6.4gCu时,两池中共产生气体3.36L(标准状况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】井水冒泡、有异味和变浑浊是地震的常见征兆,其中可能涉及地下硫铁矿(FeS2)发生的反应:FeS2+H2O═Q+S+H2S↑ (已配平),则物质Q是( )
A.Fe2O3
B.FeO
C.Fe(OH)2
D.Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据表中信息判断,下列选项不正确的是( )
序号 | 反应物 | 产物 |
① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4 |
② | Cl2、FeBr2 | FeCl3、FeBr3 |
③ | MnO | Cl2、Mn2+ |
A. 第①组反应的其余产物为H2O和O2
B. 第②组反应中参加反应的Cl2与FeBr2的物质的量之比为1∶2
C. 第③组反应中生成1 mol Cl2,转移电子 2 mol
D. 氧化性由强到弱顺序为MnO![]() >Cl2>Fe3+>Br2
>Cl2>Fe3+>Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元东周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
主族 周期 | I A | IIA | IIIA | IVA | VA | VIA | VIIA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)在这些元素中,化学性质最不活泼的是_____(填具体元素符号,下同),原子结构示意图为_______。元素⑩名称为_____________在周期表中的位置________________。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是_________,碱性最强的化合物的电子式是________________。
(3)用电子式表示元素④与⑥的化合物的形成过程___________________,该化合物属于_____(填“共价”或“离子”)化合物。
(4)表示①与⑦的化合物的电子式________,该化合物是由_______(填“极性”、“非极性”)键形成的。
(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是_________(用化学式表示)。
(6)元素③的氢化物的结构式为________;该氢化物常温下和元素⑦的单质反应的化学方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(i)燃料电池是目前正在探索的一种新型电池,目前已经使用的氢氧燃料电池的基本反应是正极:O2+2H2O+4e-=4OH-,回答下列问题:
(1)电解质溶液为____________。
(2)负极发生________反应(填“氧化”或“还原”)。写出其电极反应式___________。
(3)若反应后得到5.4 g液态水,此时氢氧燃料电池转移的电子数为________。
(ii)如图所示的装置,在盛有水的烧杯中,铁圈和银圈的连接处吊着一根绝缘的细丝,使之平衡。小心地往烧杯中央滴入CuSO4溶液。

(1)片刻后可观察到的现象是(指悬吊的金属圈)________。
A.铁圈和银圈左右摇摆不定 B.保持平衡状态不变
C.铁圈向下倾斜 D.银圈向下倾斜
(2)产生上述现象的原因是___________________________________。
(iii)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式:___________________________。
(2)若将(1)中的反应设计成原电池,并写出正、负极电极反应式。
正极反应:______________________,负极反应:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业中,每生产2molNH3 , 放出92.4kJ热量.
(1)写出合成氨反应的热化学方程式为 .
(2)已知: 
1mol N﹣H键断裂吸收的能量等于kJ.
(3)已知关于铁的氧化物存在下列三个热化学方程式: Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=﹣24.8kJ/mol ①
Fe2O3(s)+ ![]() CO(g)═
CO(g)═ ![]() Fe3O4(s)+
Fe3O4(s)+ ![]() CO2(g)△H=﹣15.73kJ/mol ②
CO2(g)△H=﹣15.73kJ/mol ②
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+640.4kJ/mol ③
则CO还原FeO的热化学方程式为CO(g)+FeO(s)═Fe(s)+CO2(g)△H=kJ/mol.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com