
【题目】工业上可用甲烷和氧气按9:1的体积比混合,在200℃和10MPa的条件下,通过铜制管道反应制得甲醇:2CH4+O2=2CH3COH。
(1)已知一定条件下,CH4和CH3COH燃烧的热化学方程式分别为:
CH4(g)+SO2(g)=CO2(g)+2H2(g) △H=-802kJ/lmol
CH3OH(g)+l.5O2(g)=CO2(g)+2H2O(g) △H=-677kJ/mol
则2CH4(g)+O2(g)=2CH3OH(g) △H=__________
(2)甲烷固体氧化物燃料电池属于第三代燃料电池,是一种在中高温下直接将储存在燃料和氧化剂中的化学能高效、环境友好地转化成电能的全固态化学发电装置。其工作原理如下图所示。a是电池的____极(填“正”或“负”) ,b极的电极反应式为__________。

(3)工业上合成甲醇的另一种方法为:
CO(g)+2H2(g) ![]() CH3OH(g) △H=-90kJ/mol
CH3OH(g) △H=-90kJ/mol
T℃时,将2mol CO 和4molH2充入1L 的密闭容器中,测得H2的物质的量随时间变化如下图实线所示。
① 能用于判断反应已达化学平衡状态的是____________。
A.气体的总压强不再改变
B. H2与CH3OH的体积比不再改变
C.气体的密度不再改变
D.单位时间内消耗1mol CO,同时生成1mol CH3OH
② 请计算出T℃ 时反应的平衡常数K=_________________。
③ 仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图中虚线所示。曲线Ⅰ对应的实验条件改变是:________;曲线Ⅱ对应的实验条件改变是_________0。

④ a、b、c三点逆反应速率由大到小排列的顺序是__________。
【答案】 -250KJ/mol 正 CH4+4O2-8e-=CO2+2H2O AB 3(mol/L)2 升高温度 增大压强(或增大CO的浓度) b>c>a
【解析】试题分析:(1)根据盖斯定律计算反应热;(2)根据![]() 移动方向,可知a是正极,b是负极;(3)根据平衡状态的直接判据和间接判据判断平衡状态;利用三段式计算平衡常数;曲线Ⅰ反应速率加快、氢气的物质的量增大;曲线Ⅱ反应速率加快、氢气的物质的量减小;
移动方向,可知a是正极,b是负极;(3)根据平衡状态的直接判据和间接判据判断平衡状态;利用三段式计算平衡常数;曲线Ⅰ反应速率加快、氢气的物质的量增大;曲线Ⅱ反应速率加快、氢气的物质的量减小;
解析:(1)
CH4(g)+SO2(g)=CO2(g)+2H2(g) △H=-802KJ/lmol
②CH3COH(g)+l.5O2(g)=CO2(g)+2H2O(g) △H=-677kJ/mol
根据盖斯定律,2×①-2×②得2CH4(g)+O2(g)=2CH3OH(g) △H= -250KJ/mol;(2)根据![]() 移动方向,可知a是正极,b是负极,负极甲烷失电子生成二氧化碳和水,负极反应式为CH4+4O2--8e-=CO2+2H2O;
移动方向,可知a是正极,b是负极,负极甲烷失电子生成二氧化碳和水,负极反应式为CH4+4O2--8e-=CO2+2H2O;
(3)①CO(g)+2H2(g) ![]() CH3OH(g) 反应,气体系数和不同;
CH3OH(g) 反应,气体系数和不同;
A.气体物质的量是变量,所以气体的总压强不再改变,一定平衡;
B. 氢气是反应物、甲醇是生成物,H2与CH3OH的体积比不再改变,一定平衡;
C.根据![]() ,气体质量不变、容器体积不变,所以密度是常量,气体的密度不再改变,不一定平衡;
,气体质量不变、容器体积不变,所以密度是常量,气体的密度不再改变,不一定平衡;
D.消耗CO,生成CH3OH都是正反应方向,故D不一定平衡;
② 根据图像可知

![]() 3;
3;
曲线Ⅰ反应速率加快、氢气的物质的量增大,说明平衡逆向移动,所以改变条件是升高温度;曲线Ⅱ反应速率加快、氢气的物质的量减小,说明平衡正向移动,所以改变条件是增大压强;④b点温度高于c点,所以平衡时逆反应速率b>c,a点、c点温度相同,但c点甲醇浓度大于a,所以逆反应速率c>a,a、b、c三点逆反应速率由大到小排列的顺序是b>c>a。


科目:高中化学 来源: 题型:
【题目】从薄荷中提取的薄荷醇可制成医药。薄荷醇的结构简式如下图,下列说法正确的是
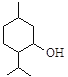
A. 薄荷醇分子式为C10H20O,它是环己醇的同系物
B. 薄荷醇的分子中至少有12个原子处于同一平面上
C. 薄荷醇在Cu或Ag做催化剂、加热条件下能被O2氧化为醛
D. 在一定条件下,薄荷醇能发生取代反应、消去反应和聚合反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请回答有关问题:
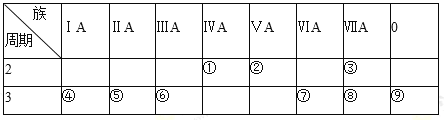
(1)①的元素符号为 _________;⑨的原子结构示意图为 _________。
(2)第3周期主族元素中,原子半径最小的是_________(用元素符号表示)。
(3)表中元素的气态氢化物中最稳定的是_____________________(用化学式表示)。
(4)①、②、⑦、⑧四种元素的最高价氧化物的水化物中酸性最强的是_________(用化学式表示)。
(5)⑤、⑥两种元素相比较,金属性较强的是_________(填元素名称),可以验证这一结论的实验是_________(填正确选项的编号)。
A.将在空气中放置已久的这两种元素的块状单质分別放入NaOH溶液中,比较反应的剧烈程度
B.将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应,比较反应的剧烈程度
C.将形状,大小相同的这两种元素的单质分别和热水作用,并滴入酚酞试液,比较反应的剧烈程度
(6)④和⑥两种元素的最高价氧化物的水化物在水溶液中反应的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】医用麻醉药苄佐卡因E和食品防腐剂J的合成路线如下:

已知:I. M代表E分子结构中的一部分
II. ![]()
请回答下列问题:
(1) 芳香烃A的质谱图如下图,其名称是____________________。

(2) E中所含官能团的名称是________________________。
(3)由A制备F的反应类型是____________________。
(4)C能与NaHCO3溶液反应,反应①的化学方程式是____________________。
(5)反应②中试剂ⅱ是_______________。(填序号)
a.高锰酸钾酸性溶液 b.氢氧化钠溶液
(6)写出反应③的化学反应方程式____________。
(7) J有多种同分异构体,写出其中所有符合下列条件的结构简式_______________。
a.为苯的邻位二元取代物,且与FeCl3可以发生显色反应
b.与J具有相同的官能团,且能发生银镜反应
(8)以A为起始原料,选用必要的无机试剂合成涂改液的主要成分亚甲基环己烷(![]() ),写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):_____________。
),写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,我国在超导研究方面居世界领先地位,铊(Tl)是超导体的组成成分之一,铊位于第6周期ⅢA族,下列对铊的性质推导可能正确的是( )
①铊是易导电的银白色金属
②Tl(OH)3是两性氢氧化物
③Tl3+的氧化能力比Al3+的强
④单质能跟稀HNO3反应生成硝酸盐
A. ①④ B. ②③ C. 只有① D. 只有④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子中,因发生氧化还原反应而不能大量共存的是
A. K+、H+、Fe2+、MnO4-B. Fe3+、Ba2+、SO42-、NO3-
C. Al3+、Na+、SO42-、CO32-D. Fe3+、H+、SO42-、ClO-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com