
【题目】(1)指出下图所表示的共价键名称,并列举含有该共价键的一种物质,写出其分子式。

共价键名称 举例
①__________,__________;
②__________,__________;
③__________,__________;
④__________,__________;
⑤__________,__________。
(2)某有机物分子的结构简式为CH2=CHCOOH,该分子中有________个σ键,________个π键,有__________种极性键,__________(填“有”或“没有”)非极性键。
(3)用电子式表示Cl2、NH3、H2S、CO2分子的形成过程________。
【答案】 s-sσ H2 s-pσ HCl p-pσ Cl2 pz-pzπ N2 py-pyπ N2 8 2 4 有 ![]() ;
;![]() ;
;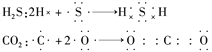
【解析】(1)①是由s轨道与s轨道形成的s-sσ键,例如氢气就是s-sσ键;②是s轨道与p轨道形成的s-pσ键,例如氯化氢就是s-pσ键;③是p轨道与p轨道形成的p-pσ键,例如氯气就是p-pσ;④是由“肩并肩”重叠形成的pz-pzπ键,例如氮气等;⑤是由“肩并肩”重叠形成的py-pyπ键,例如氮气等。(2)丙烯酸![]() 有3个C-Hσ键、2个C-Cσ键、2个C-Oσ键、1个O-Hσ键、C=C和C=O中分别有1个π键;有C-H、C==O、C-O、O-H 4种极性键,还有C=C、C-C非极性键。(3)氯气是单质,其形成过程为
有3个C-Hσ键、2个C-Cσ键、2个C-Oσ键、1个O-Hσ键、C=C和C=O中分别有1个π键;有C-H、C==O、C-O、O-H 4种极性键,还有C=C、C-C非极性键。(3)氯气是单质,其形成过程为![]() ;氨气、硫化氢、二氧化碳均是共价化合物,其形成过程分别为
;氨气、硫化氢、二氧化碳均是共价化合物,其形成过程分别为 、
、![]() 、
、![]() 。
。


 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
【题目】常温下,在溶液中可发生以下反应:
①H++Z-+XO42-→X2++Z2+H2O(未配平),②2M2++R2=2M3++2R-
③2![]() +Z2=R2+2
+Z2=R2+2![]() 。由此判断下列说法正确的是
。由此判断下列说法正确的是
A.氧化性强弱顺序为XO42->Z2>R2>M3+
B.Z2在③中发生氧化反应
C.R元素在反应②中被氧化,在③中被还原
D.常温下反应不可进行2M2++Z2=2M3++2Z-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是 ( )
A.凡是能电离出H+的化合物均属于酸
B.由一种元素组成的物质一定是单质
C.纯碱从物质的分类看不属于碱
D.盐类物质一定含有金属离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种元素的原子电子层结构如下:
A.1s22s22p63s23p63d54s1;B.1s22s22p63s2;C.1s22s22p6;D.1s22s22p63s23p;E.[Ar]4s1。试回答:
(1)哪个式子是错误的________,它违背了________。
(2)哪个式子表示稀有气体原子________。
(3)A的元素符号是________,写出其价电子排布的轨道表示式________。
(4)B和E的金属性强弱关系为________(用元素符号表示),可以说明这一事实的依据是(写出2点)__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列三种溶液:①45%的乙醇溶液、②汽油和氯化钾溶液、③氯化钠和单质碘的水溶液,分离上述各组混合液的正确方法依次是( )
A.分液、萃取、蒸馏B.萃取、蒸馏、分液
C.分液、蒸馏、萃取D.蒸馏、分液、萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】诺卜醇可用于调制木香型化妆品及皂用香精。一种制备方法如图所示,下列说法正确的是
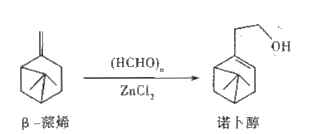
A. 可用溴的CCl4溶液区别β-蒎烯与诺卜醇
B. β-蒎烯的饱和碳原子上的一氯代物最多有7种
C. β-蒎烯和诺卜醇分子中都有一个由5个碳原子构成的四面体
D. 可用乙酸检验β-蒎烯是否含有诺卜醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚砷酸(H3AsO3)可用于治疗白血病,在溶液中存在多种微粒形态。向1L0.1mol·L-1 H3AsO3溶液中逐滴加入0.1mol·L-1KOH溶液,各种微粒物质的量分数与溶液的pH关系如下图所示。下列说法正确的是( )

A. H3AsO3的电离常数Ka1的数量级为10-9
B. pH在8.0~10.0时,反应的离子方程式:H3AsO3+OH-=H2AsO3-+H2O
C. M点对应的溶液中:c(H2AsO3-)+c(HAsO32-)+c(AsO33-)+c(H3AsO3)=0.1mol·L-1
D. pH=12时,溶液中:c(H2AsO3-)+2c(HAsO32-)+3c(AsO33-)+c(H3AsO3)>c(H+)+c(K+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合肼(N2H4·H2O)是无色、有强还原性的液体,实验室制备水合肼的原理为:CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl据此,某学生设计了下列实验。
【制备NaClO溶液】实验装置如下图图甲所示(部分夹持装置已省略)
已知:3NaClO![]() 2NaCl+NaClO3
2NaCl+NaClO3
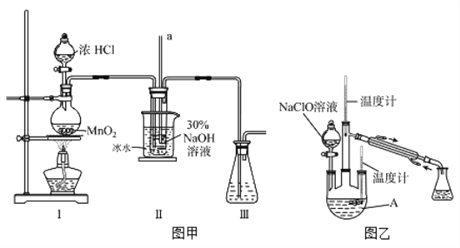
(1)配制30 %NaOH溶液时,所需玻璃仪器除量筒外还有__________(填字母)。
A.容量瓶 B.烧杯 C.移液管 D.玻璃棒
(2)装置I中发生的离子反应方程式是_______________;Ⅱ中玻璃管a的作用为____________;Ⅱ中用冰水浴控制温度在30℃以下,其主要目的___________________
【制取水合肼】实验装置如上图图乙所示
(3)反应过程中,如果分液漏斗中溶液的滴速过快, 部分N2H4·H2O参与A中反应并产生大量氮气,产品产率因此降低,请写出降低产率的相关化学反应方程式____________________;充分反应后,加热蒸馏A内的溶液即可得到水合肼的粗产品。
【测定肼的含量】
(4)称取馏分0.3000 g,加水配成20.0 mL溶液,一定条件下用0.1500 mol·L-1的I2溶液滴定。已知: N2H4·H2O + 2I2 = N2↑+ 4HI + H2O。
①滴定时,可以选用的指示剂为____________;
②实验测得消耗I2溶液的平均值为20. 00 mL,馏分中N2H4·H2O的质量分数为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下所示:
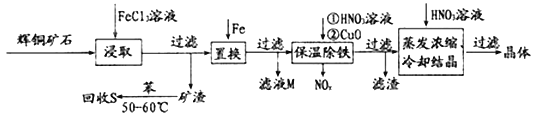
(1)“浸取”时,为了提高浸取速率可采取的措施有___________________________(任写一点)。写出“浸取”过程中Cu2S溶解时发生反应的离子方程式:_____________________________________。
(2)“保温除铁”过程中,加入CuO的目的是_________________________________________;“蒸发浓缩、冷却结晶”过程中,加入HNO3调节溶液的pH,其理由是____________________。
(3)气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为________________________________。向“滤液M”中加入(或通入)_____ (填字母),可得到另一种可循环利用的物质。
a.铁 b.氯气 c.高锰酸钾
(4)“回收S”过程中温度控制在50 ~60℃之间,不宜过高或过低的原因是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com