
����Ŀ���������Ļ������ڹ�ũҵ�����������о�����ҪӦ�á���ش�����������
(1)���������г���N2H4��Ϊ����������ȼ����N2H4�백�����ƣ���һ�ּ������壬������ˮ����������N2H4��H2O���õ��뷽��ʽ��ʾN2H4��H2O�Լ��Ե�ԭ�� ��
��2���ں��������£�1 mol NO2������C������Ӧ:2NO2(g)+2C(s)![]() N2(g)+2CO2(g)�����ƽ��ʱNO2��CO2�����ʵ���Ũ����ƽ����ѹ�Ĺ�ϵ��ͼ��ʾ��
N2(g)+2CO2(g)�����ƽ��ʱNO2��CO2�����ʵ���Ũ����ƽ����ѹ�Ĺ�ϵ��ͼ��ʾ��

��A��B�����Ũ��ƽ�ⳣ����ϵ��Kc(A) Kc(B)�������������=������
��A��B��C������NO2��ת������ߵ��� ������A������B������C��������
������C��ʱ�÷�Ӧ��ѹǿƽ�ⳣ��Kp= ���г�����ʽ����������Kp����ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ����ѹ�����ʵ�����������
��3��������ĵ���ƽ�ⳣ��Ka=5.1��10-4��298K�����������ʺ���������ơ�
����֪298K ʱ��H2CO��Ka1=4.2��10-7 ��Ka2=5.61��10-11������2mol̼���Ƶ���Һ�м���1mol��HNO2������Һ��CO32-��HCO3-��NO2-������Ũ���ɴ�С�� ��
����10mL0.1mol/L����������Һ���뵽10mL0.1mol/L��ˮ����֪��25��ʱ��һˮ�ϰ���Ki= 1.8��10-5����,���������ҺΪ________��������������������������������������
��4��һ��ú̿������������Ԫ����CaSO4���γɹ̶���������������CO�ֻ���CaSO4������ѧ��Ӧ����ص��Ȼ�ѧ����ʽ���£�
��CaSO4��s��+CO��g��![]() CaO��s��+SO2��g��+CO2��g����H = +210.5kJmol-1
CaO��s��+SO2��g��+CO2��g����H = +210.5kJmol-1
��CaSO4��s��+ 4CO��g��![]() CaS��s��+ 4CO2��g�� ��H = -189.2kJmol-1
CaS��s��+ 4CO2��g�� ��H = -189.2kJmol-1
��ӦCaO(s)+3CO(g)+SO2(g) ![]() CaS(s)+3CO2(g) ��H= kJmol-1��
CaS(s)+3CO2(g) ��H= kJmol-1��
(5)H2S��������ˮ�γɵ���������һ�ֶ�Ԫ���ᣬ25��ʱ����0.10 mol��L-1H2S��Һ�У�ͨ��HCl��������NaOH�����Ե�����ҺpH����ҺpH��c(S2-)��ϵ��ͼ��ʾ(������Һ����ı仯��H2S�Ļӷ�)��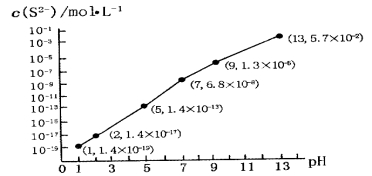
��pH=13ʱ����Һ�е�c(H2S)+c(HS-)=__________mol��L-1��
��ij��Һ��0.010 mol��L-1Fe2+��0.10 mol��L-1H2S������ҺpH=______ʱ��Fe2+��ʼ����������֪��KSP(FeS)=1.4��10-19��
��������1��N2H4��H2O![]() N2H5++OH-����N2H4+H2O
N2H5++OH-����N2H4+H2O![]() N2H5++OH-����2����=��A
N2H5++OH-����2����=��A
��2 MPa��3��[HCO3-]��[NO2-]��[CO32-] ��2�����ԣ�4��-399.7 ��5����0.043 ��2
��������
�����������1���û�����������백�����ƣ�˵���ܵ�������������Ӷ��Լ��ԣ������Һ�Լ��Ե����ӷ���ʽΪN2H4��H2O![]() N2H5++OH-��
N2H5++OH-��
��2����A��B������¶���ͬ����ƽ�ⳣ����ϵ��Kc(A��Kc(B)��
������Ӧ���������Ŀ��淴Ӧ��ѹǿԽ��Խ������NO2��ת��������A��B��C������NO2��ת������ߵ���A����
�� 2NO2(g)+2C(s)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
��ʼ����mol�� 1 0 0
ת������mol�� 2x x 2x
ƽ������mol�� 1-2x x 2x
C��CO2��NO2��Ũ����ȣ���1��2x��2x�����x��0.25�����ʱ�������������ʵ�����1��x��1.25������C��ʱ�÷�Ӧ��ѹǿƽ�ⳣ��Kp�� ��2MPa��
��2MPa��
��3������������ĵ���ƽ�ⳣ��Ka=5.1��10-4��H2CO��Ka1=4.2��10-7��Ka2=5.61��10-11���ж������������ǿ��̼�ᣬ�������2mol̼���Ƶ���Һ�м���1mol��HNO2������1mol̼�����ơ�1mol�������ƣ����ʣ��1mol̼������ˮ��̶ȴ�С˳��ΪCO32-��NO2-��ˮ������HCO3-��������Һ��CO32-��HCO3-��NO2-���ӵ�Ũ�ȴ�С��ϵΪ[HCO3-]��[NO2-]��[CO32-]��
����֪��25��ʱ��һˮ�ϰ���Ki=1.8��10-5��������ĵ���ƽ�ⳣ��Ka=5.1��10-4������������ĵ���̶ȴ���һˮ�ϰ��ĵ���̶ȣ���笠����ӵ�ˮ��̶ȴ�������������ӵij̶ȣ�����Խ��Խˮ�⣬笠����ӵ�ˮ��̶ȴ��������������ҺΪ������
��4����֪��CaSO4��s��+CO��g��![]() CaO��s��+SO2��g��+CO2��g����H = +210.5kJmol-1
CaO��s��+SO2��g��+CO2��g����H = +210.5kJmol-1
��CaSO4��s��+ 4CO��g��![]() CaS��s��+ 4CO2��g�� ��H = -189.2kJmol-1
CaS��s��+ 4CO2��g�� ��H = -189.2kJmol-1
�����ݸ�˹���ɿ�֪�����ټ��õ���ӦCaO(s)+3CO(g)+SO2(g) ![]() CaS(s)+3CO2(g)����Ӧ�ȡ�H��-399.7kJmol-1��
CaS(s)+3CO2(g)����Ӧ�ȡ�H��-399.7kJmol-1��
��5����������ҺpH��c��S2-����ϵͼpH=13ʱ��c��S2-����5.7��10-2mol/L����0.10molL-1H2S��Һ�и������غ�c��H2S��+c��HS-��+c��S2-����0.10molL-1������c��H2S��+c��HS-����0.1-5.7��10-2��0.043mol/L��
����Qc=Ksp��FeS��ʱ��ʼ����������c��S2-����Ksp(FeS)��c(Fe2+)��1.4��1019mol/L�����ͼ��ó���ʱ��pH=2������pH=2ʱ�������ӿ�ʼ������


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�Ksp(CaSO4)=9��10-6,������CaSO4��ˮ�еij����ܽ�ƽ������ͼ������˵����ȷ����( )

A.CaSO4��ϡ�����е��ܽ��Ա��ڴ�ˮ�е��ܽ���ǿ
B.b�㽫�г������ɣ�ƽ�����Һ��c(SO42-)һ������3��10-3 mol/L
C.d����Һͨ���������Ա䵽c��
D.a���Ӧ��Ksp����c���Ӧ��Ksp
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������зḻ�����̿��Դ�Ϊ��Ҫԭ������MnSO4�Ĺ�ҵ�������£�

��֪�������̿����Ҫ�ɷ���MnO2���������Fe2O3��Al2O3��CuO��NiO��SiO2���������ʡ�
�ڼ������ӳ���ʱ������Ϣ���£�

(1)д�����������SO2��MnO2��Ӧ�����ӷ���ʽ___________��
(2)Ϊ��̽��MnO2��SO2��Ӧ�����ij�о�С�齫����SO2β����һ�������Ŀ���ͨ��MnO2����Һ�У������¶Ȳ��������£������Һ��c(Mn2+)��c(SO42��)�淴Ӧʱ��ı仯��ͼ��ʾ��������Һ��c(Mn2+)��c(SO42��)�ı仯�������Բ����ԭ����___________��

(3)����I������������������Ҫ����Ϊ����ҺI�м������̿���p=5.2~6.0���ң�ʹ��Fe3+��Al3+������ȫ���ټ������̿���衢���ˡ�д����ҺI������Fe2+��ص����ӷ���ʽ___________��___________��
(4)������������ͭ����������Ҫ����Ϊ������Һ���м���MnS(������)����ֽ��裬���ˡ�����MnS�ܳ�ȥ��Һ����Cu2+��Ni2+��ԭ����___________��
(5)��MnSO4��ҺΪԭ�Ͽ�ͨ����ⷨ�Ʊ���������������MnO2����װ����ͼ��ʾ��

��������������缫��ӦʽΪ___________�����һ��ʱ���������Һ��H+�����ʵ���___________(���������������С������������)��ʵ������������___________(������������������)��MnCl2��Һ����MnSO4��Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з���ʽ��д��ȷ����( �� )
A. NaHSO4��ˮ��Һ�еĵ��뷽��ʽ��NaHSO4===Na����![]()
B. H2SO3�ĵ��뷽��ʽ��H2SO3![]() 2H����
2H����![]()
C. CO![]() ��ˮ�ⷽ��ʽ��
��ˮ�ⷽ��ʽ��![]() ��H2O
��H2O![]()
![]() ��OH��
��OH��
D. CaCO3�ĵ��뷽��ʽ��CaCO3![]() Ca2����
Ca2����![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(NaN3)��һ��������ˮ�İ�ɫ���壬�����Ҵ������������ѣ������ںϳɿ�����ͷ�߾���ҩ����м��塢������ȫ���ҵ�ҩ���ȡ�������(NaNH2)���۵�Ϊ210�棬�е�Ϊ400�棬��ˮ��Һ����ˮ�⡣ʵ������ȡ�������Ƶ�ʵ�鲽�輰ʵ��װ�����£�
�ٴ�ֹˮ��K1���ر�ֹˮ��K2������װ��Dһ��ʱ�䣻
�ڼ���װ��A�еĽ����ƣ�ʹ���ۻ�����ַ�Ӧ����ֹͣ����װ��D���ر�K1��
����װ��A��b�����ڳ�����Ƚ��ʲ����ȵ�210��220�棬��ֹˮ��K2��ͨ��N2O��
����ȴ��������м����Ҵ�����ѹŨ���ᾧ���ٹ��ˣ���������ϴ�ӣ����ɡ�

�ش��������⣺
(1)װ��B��ʢ�ŵ�ҩƷΪ____________��װ��C����Ҫ������________________��
(2)�������ۻ����Ʒ�Ӧ����NaNH2�Ļ�ѧ����ʽΪ__________��
(3)������У�Ϊ��ʹ��Ӧ���Ⱦ��ȣ�Aװ����a�����ļ��ȷ�ʽΪ_____������NaN3�Ļ�ѧ����ʽΪ_____��N2O����NH4NO3��240~245��ֽ��Ƶ�(����淋��۵�Ϊ169.6��)������ѡ������巢��װ����________(�����)��

(4)ͼ������a�õ������ʶ����ò���������Ҫԭ����_____________���������������ϴ�ӵ���ҪĿ����_______________��
(5)ʵ�����õζ����ⶨ����������Ʒ��NaN3�������������ٽ�2.500g�������500.00mL��Һ����ȡ50.00mL��Һ������ƿ�У�����50.00mL0.1010mol��L-1(NH4)2Ce(NO3)6��Һ���۳�ַ�Ӧ����Һ��ϡ�ͣ�����Һ�м���8mLŨ���ᣬ����3���ڷƆ���ָʾҺ����0.0500mol��L-1(NH4)2Fe(SO4)2����Һ�ζ�������Ce4+������Һ���Ϊ29��00mL���ⶨ���̵ķ�Ӧ����ʽΪ��
![]()
![]()
��������NaN3����������Ϊ_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ʵ����ڼ����е�Ӧ��
��1���е�������������O3�� O2 ��ͬ��ͬѹ�µ��ܶ�֮��Ϊ______��
��2����7.8gNa2R��Na+Ϊ0.2mol����Na2R��Ħ������Ϊ_____��R�����ԭ������Ϊ___��
��3��������Ϊ51��32��34��NH3��CH4��H2S�������ʵ���֮��Ϊ___������������ԭ����֮��Ϊ__������������֮��Ϊ___��
��4����150��C��m gNH4HCO3������ȫ�ֽ�����NH3��CO2��H2O�������û�������H2������ܶ�Ϊd�����ú�m��d�Ĵ���ʽ��ʾ�����������ʵ���Ϊ_________��
��5��ij�����������������Ϊ36.5%���ܶ�Ϊ1.18g/cm3,����������ʵ���Ũ��Ϊ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ڼ��������¿ɻ�ԭ����ͭ����������ˮ�����⣬����̼�������ij��ѧС��������ͼװ��̽���䷴Ӧ���

[��������]��CO����������Һ��Ӧ��CO��2[Ag(NH3)2]����2OH��===2Ag����2NH4+��CO32����2NH3��
��Cu2OΪ��ɫ������Ag+��Ӧ���ܷ�����Ӧ��Cu2O��2H��===Cu2+��Cu��H2O��
��1��װ��A�з�Ӧ�Ļ�ѧ����ʽΪ___________________________________________��
��2�������������װ�ô����ҵ�����˳��ΪA��__________________��(����ĸ���)
��3��ʵ���еμ�ϡ����IJ���Ϊ______________________________________________��
��4����֪��������к���CO����װ��C�пɹ۲쵽��������________________��װ��F������Ϊ_________________________________________��
��5������Ӧ������װ��D���Թ��й���ȫ����Ϊ��ɫ��
�����ʵ��֤����ɫ�����к���Cu2O��______________________________________________��
����֤����ɫ�������Ƿ���Cu����ͬѧ�������ʵ�飺��������ɫ�����м�������0.1mol��L1AgNO3��Һ��������Һ�������ݴ��жϺ�ɫ�����к���Cu����ͬѧ��Ϊ�÷�������������֤����ͬѧ�Ľ��ۣ������������¶Ա�ʵ�飬��ɱ������ݡ�
ʵ�鲽��(��Ҫ��д�������������) | Ԥ������ͽ��� |
__________________ | ���۲쵽��Һ����������֤����ɫ�����к���Cu�����۲쵽��Һ����������֤����ɫ�����к���Cu |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ����Ƴ��ǹ�����������Ч�������ʵ�ֵ�⸻���ط�ˮ���ܺ���H2(װ����ͼ)���ܷ�ӦΪ![]() ������˵������ȷ����
������˵������ȷ����

A. a�缫��ӦΪ��![]()
B. bΪ����������������Ӧ
C. ���һ��ʱ��b������ҺpH����
D. ��ˮ��ÿͨ��6mol���ӣ�a�缫����1molN2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ������˵����ȷ����
A. �����£�pH =1�������к���H+����ĿΪ0.1NA
B. ��״���£�22.4 LCl2��Fe��ȫ��Ӧʱ��ת�Ƶ�����Ϊ3NA
C. 32gO2��32gO3������ԭ������Ϊ2NA
D. ���³�ѹ�£�28 g��ϩ����2NA��̼̼˫��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com