
【题目】钴是一种中等活泼金属,化合价为+2价和+3价,其中CoC12易溶于水。某校同学设计实验制取(CH3COO)2Co(乙酸钴)并验证其分解产物。回答下列问题:
(1)甲同学用Co2O3与盐酸反应制备CoC124H2O,其实验装置如下:

①烧瓶中发生反应的离子方程式为______。
②由烧瓶中的溶液制取干燥的CoC124H2O,还需经过的操作有蒸发浓缩、______、洗涤、干燥等。
(2)乙同学利用甲同学制得的CoC124H2O在醋酸氛围中制得无水(CH3COO)2Co,并利用下列装置检验(CH3COO)2Co在氮气气氛中的分解产物。已知PdC12溶液能被CO还原为Pd。

①装置E、F是用于检验CO和CO2的,其中盛放PdC12溶液的是装置______(填“E”或“F”)。
②装置G的作用是______;E、F、G中的试剂均足量,观察到I中氧化铜变红,J中固体由白色变蓝色,K中石灰水变浑浊,则可得出的结论是______。
③通氮气的作用是______。
④实验结束时,先熄灭D和I处的酒精灯,一段时间后再关闭弹簧夹,其目的是______。
⑤若乙酸钴最终分解生成固态氧化物X、CO、CO2、C2H6,且n(X):n(CO):n(CO2):n(C2H6)=1:4:2:3(空气中的成分不参与反应),则乙酸钴在空气气氛中分解的化学方程式为______。
【答案】Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O 冷却结晶、过滤 F 除去CO2 分解产物中还含有一种或多种含C、H元素的物质 将D中的气态产物被后续装置所吸收,或排除装置中的空气或不使K中水蒸气进入盛无水CuSO4的干燥管中 防止倒吸 3(CH3COO)2Co![]() Co3O4+4CO↑+2CO2↑+3C2H6↑
Co3O4+4CO↑+2CO2↑+3C2H6↑
【解析】
(1)①已知,盐酸、COCl2易溶于水,写离子形式,氧化物、单质写化学式,反应的离子方程式: Co2O3+2Cl-+6H+=2Co2++Cl2↑+3H2O;
②因反应产物中含有结晶水,则不能直接加热制取,应采用:蒸发浓缩、降温结晶、过滤、洗涤干燥等操作;
(2)①装置E、F是用于检验CO和CO2,PdCl2溶液能被CO还原为Pd,因此装置E用于检验CO2,F装置用于检验CO,装盛足量PdCl2溶液;
②装置G的作用是吸收CO2,以防在装置内对后续实验产生干扰;氧化铜变红,则氧化铜被还原,无水硫酸铜变蓝,说明反应中产生水,石灰水变浑浊,则说明产生二氧化碳气体,则说明分解产物中含有一种或多种含有C、H元素的物质;
③通入氮气的作用为使D装置中产生的气体全部进入后续装置,且排净后续装置内的氧气等;
④实验结束时,先熄天D和I处的酒精灯,一段时间后装置D、E内的温度降低后再停止通入气体可以有效防止倒吸;
⑤乙酸钴受热分解,空气中的成分不参与反应生成物有固态氧化物X、CO、CO2、C2H6,且n(X) ︰ n(CO)︰n(CO2) ︰n(C2H6)=1︰4︰2︰3,根据原子守恒配平即可;
(1)①已知,盐酸、COCl2易溶于水,写离子形式,氧化物、单质写化学式,反应的离子方程式: Co2O3+2Cl-+6H+=2Co2++Cl2↑+3H2O;
②因反应产物中含有结晶水,则不能直接加热制取,应采用:蒸发浓缩、降温结晶、过滤、洗涤干燥等操作;
(2)①装置E、F是用于检验CO和CO2,PdCl2溶液能被CO还原为Pd,因此装置E用于检验CO2,F装置用于检验CO,装盛足量PdCl2溶液;
②装置G的作用是吸收CO2,以防在装置内对后续实验产生干扰;氧化铜变红,则氧化铜被还原,无水硫酸铜变蓝,说明反应中产生水,石灰水变浑浊,则说明产生二氧化碳气体,则说明分解产物中含有一种或多种含有C、H元素的物质,答案为:除去CO2;分解产物中含有一种或多种含C、H元素的物质;
③通入氮气的作用为使D装置中产生的气体全部进入后续装置,且排净后续装置内的氧气等,答案为:将D中的气态产物带入后续装置(或排除装置中的空气或不使K中水蒸气进入盛无水硫酸铜的干燥管等);
④实验结束时,先熄天D和I处的酒精灯,一段时间后装置D、E内的温度降低后再停止通入气体可以有效防止倒吸,答案为:防止倒吸;
⑤乙酸钴受热分解,空气中的成分不参与反应生成物有固态氧化物X、CO、CO2、C2H6,且n(X) ︰ n(CO)︰n(CO2) ︰n(C2H6)=1︰4︰2︰3,根据原子守恒配平即可,反应式为:3(CH3COO)2Co ![]() Co3O4+4CO↑+2CO2↑+3C2H6↑;
Co3O4+4CO↑+2CO2↑+3C2H6↑;


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
【题目】为了测定某有机物A的结构,做如下实验:

①将4.4g该有机物完全燃烧,生成 0.2mol CO2和3.6g水;
②用质谱仪测定其相对分子质量,得如图1所示的质谱图;
③A的核磁共振氢谱如图2:
试回答下列问题:
(1)有机物A的相对分子质量是_____________
(2)有机物A的实验式是_____________
(3)有机物A的分子式是_____________
(4)红外光谱上发现A有﹣COOH和2个﹣CH3则有机物A的结构简式 ________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去)。请填空:

(1)试管a中需要加入浓硫酸、冰醋酸和乙醇各2 mL,正确的加入顺序及操作是______________________。
(2)为防止a中的液体在实验时发生暴沸,在加热前应采取的措施是________。
(3)实验中加热试管a的目的是:①______________;②______________。
(4)试管b中加有饱和Na2CO3溶液,其作用是________________。
(5)反应结束后,振荡试管b,静置。观察到的现象是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,AgX(X=CI、Br)的溶度积与c(Ag+)和c(X-)的相互关系如图所示,其中A线表示AgCl,B线表示AgBr,已知p(Ag+)=-lgc(Ag+),p(X-)=-lgc(X-)。下列说法正确的是

A. c点可表示AgCl的不饱和溶液
B. b点的AgCl溶液加入AgNO3晶体可以变成a点
C. AgCl(s)+Br-(aq) →AgBr(s)+CI(aq)平衡常数K=10-4
D. a点AgCl溶液和b点AgBr溶液等体积混合,会析出AgBr沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】尿素是一种重要的氮肥,它的合成主要发生以下2步反应:
反应1:2NH3(g)+CO2(g) ![]() NH4COONH2(1) △H1=a kJ·mol-1
NH4COONH2(1) △H1=a kJ·mol-1
反应2:NH4COONH2(1)=====NH2CONH2(1)+H2O(1) △H2=b kJ·mol-1
回答下列问题:
(1)写出合成尿素的热化学方程式:_____________________(用含a、b的代数式表示)。写出一种可以提高NH3平衡转化率的措施:_______________________________。
(2)95℃时,在2L恒容密闭容器中加入3mol氨气和1molCO2使之充分反应合成尿素,达到平衡时,CO2的转化率为60%,则此温度下合成尿素的平衡常数是________________(保留2位小数)。
(3)下表为反应1和反应2在不同温度下达到平衡时所测得的平衡常数(K)的数据。

①从上表数据可推出b_____(填“>”或“<”)0,理由是______________________。
②升高温度,反应1的反应速率将_________(填“增大”或“减小”)。
③下图是合成尿素时温度对二氧化碳转化率的影响曲线。从图中可知A、B、C三点对应的温度下该反应的平衡常数大小关系是_________________(用KA、KB、KC表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应的是( )
A. SO3+ H2O= H2SO4 B. NH4Cl ![]() NH3
NH3![]() +HCl
+HCl![]()
C. Fe+CuSO4= FeSO4+Cu D. NaOH+HNO3=NaNO3+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取O2和Cl2的化学反应方程式分别为①2KClO3 ![]() 2KCl+3O2↑;②MnO2+4HCl(浓)
2KCl+3O2↑;②MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,则下列说法正确的是( )
MnCl2+Cl2↑+2H2O,则下列说法正确的是( )
A. 均为氧化还原反应
B. ②中MnO2为还原剂
C. ①中反应前后MnO2质量不发生变化
D. ①中反应前后MnO2化学性质改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验(苯,一种不溶于水,密度比水小的液体):
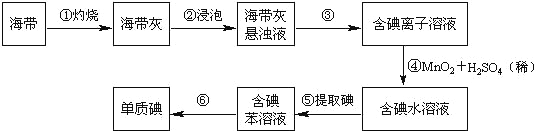
请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是_______(从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是_______;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是_______。
(3)步骤⑤是萃取、分液,某学生选择用苯来提取碘的理由是_______。在分液操作中,应充分振荡,然后静置,待分层后______(填标号),以下略。
A.直接将含碘苯溶液从分液漏斗上口倒出
B.直接将含碘苯溶液从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将含碘苯溶液从下口放出
D.先将水层从分液漏斗的下口放出,再将含碘苯溶液从上口倒出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素性质的比较,正确的是
A.金属性强弱: Na >KB.原子半径大小: O > S
C.非金属性强弱: F >ClD.最高正化合价: C > N
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com