
【题目】常温下,向20mL 0.05mol·L-1的某稀酸H2B溶液中滴入0.1mol·L-1氨水,溶液中由水电离出氢离子浓度随滴入氨水体积变化如图。下列分析正确的是

A.NaHB溶液可能为酸性,也可能为碱性
B.A、B、 C三点溶液的pH是逐渐减小,D、E、F三点溶液的pH是逐渐增大
C.B点溶液c(NH4+)=2c(B2-)
D.E溶液中离子浓度大小关系:c(NH4 +)> c(B2-)> c(H+)>c(OH-)
【答案】D
【解析】
A.酸溶液中水电离出氢离子的浓度c(H+)等于溶液中氢氧根离子浓度c(OH-),即A点时,c(OH-)=1.0×10-13mol·L-1 ,则溶液中c(H+)=![]() =0.1mol·L-1,因为酸H2B为二元酸,2×0.05mol·L-1=0.1mol·L-1,所以H2B为强酸,即NaHB溶液显酸性,A错误;
=0.1mol·L-1,因为酸H2B为二元酸,2×0.05mol·L-1=0.1mol·L-1,所以H2B为强酸,即NaHB溶液显酸性,A错误;
B.随着氨水的加入,溶液的酸性减弱,溶液的pH增大,所以A、B、C三点溶液的pH是逐渐增大,D点恰好完全反应,随着氨水的加入,溶液的碱性逐渐增强,D、E、F三点溶液的pH逐渐增大,B错误;
C.D点时,氨水与H2B恰好完全反应生成(NH4)2B,(NH4)2B是强酸弱碱盐,溶液呈酸性,所以B点时溶液呈酸性,c(NH4+)<2c(B2-),C错误;
D.E点为(NH4)2B和氨水的混合物,由图可知此时溶液中铵根离子的水解程度大于一水合氨的电离,溶液呈酸性,c(NH4 +)> c(B2-)> c(H+)>c(OH-),D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】化合物X是一种黄酮类化合物的中间体,其结构简式如图所示。下列有关化合物X的说法正确的是( )
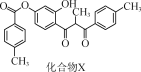
A.分子中所有碳原子共平面
B.分子中存在1个手性碳原子
C.化合物X不能使酸性KMnO4溶液褪色
D.1 mol化合物X最多可与12 mol H2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在10mL0.1mol/LNa2CO3溶液中逐滴加入0..1mol/LHCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法不正确的是
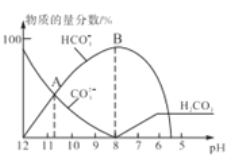
A. 常温下,水解常数Kh(CO32-)的数量级为10-4
B. 当溶液是中性时,溶液的总体积大于20mL
C. 在0.1mol/LNa2CO3溶液中:c(OH-)>c(H2CO3)+c(HCO3-)+c(H+)
D. 在B点所示的溶液中,离子浓度最大的是HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2C(s)+O2(g)===2CO(g) ΔH=-Q1kJ·mol-1;
C(s)+O2(g)===CO2(g) ΔH=-Q2kJ·mol-1;
S(s)+O2(g)===SO2(g) ΔH=-Q3kJ·mol-1。
CO与镍反应会造成镍催化剂中毒,为防止镍催化剂中毒,工业上常用SO2将CO氧化,二氧化硫转化为单质硫,则该反应的热化学方程式为 ( )
A. SO2(g)+2CO(g)===S(s)+2CO2(g) ΔH=(2Q1-2Q2+Q3) kJ·mol-1
B. S(s)+2CO(g)===SO2(g)+2C(s) ΔH=(Q1-Q3) kJ·mol-1
C. SO2(g)+2CO(g)===S(s)+2CO2(g) ΔH=(Q1-2Q2+Q3) kJ·mol-1
D. SO2(g)+2CO(g)===S(s)+2CO2(g) ΔH=(2Q1-Q2+2Q3) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】桥环化合物是指化合物中的任意两个环共用两个不直接相连的碳原子的环烃,二环[1,1,0]丁烷(![]() )是最简单的一种桥环有机物。下列关于该化合物的说法正确的是
)是最简单的一种桥环有机物。下列关于该化合物的说法正确的是
A.其同分异构体中呈环状的只有环丁烯(![]() )
)
B.构成该化合物的所有原子处于同一个平面
C.二环[1,1,0]丁烷和甲烷互为同系物
D.二环[1,1,0]丁烷的二溴代物为4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.32gNa2CO3、NaOH的固体混合物完全溶解于水,制成溶液,然后向该溶液中逐滴加入1mol/L的盐酸,所加盐酸的体积与产生CO2的体积(标准状况) 关系如图所示,下列说法中错误的是( )
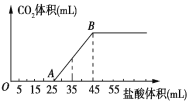
A.OA段发生反应的离子方程式为:H++OH-=H2O、CO32-+H+=HCO3-
B.A点溶液中的溶质为NaCl、NaHCO3
C.混合物中NaOH的质量0.60g
D.当加入35mL盐酸时,产生CO2的体积为224mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂用提取粗盐后的盐卤(主要成分为MgCl2)制备金属镁,其工艺流程如下,下列说法中,错误的是( )
![]()
A. 操作①发生的反应为非氧化还原反应
B. 若在实验室进行操作①只需要漏斗和烧杯两种玻璃仪器
C. 操作②是蒸发浓缩结晶
D. 在整个制备过程中,未发生置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏伽德罗常数的值,下列叙述正确的是
A.0.1mol Fe与100mL 1mol·L-1盐酸充分反应,溶液中的Fe2+数目为0.1NA
B.0.1mol·L-1(NH4)2SO4溶液中含SO42-数目为0.1NA
C.常温常压下,1.8g H2O中含有的分子数为0.1NA
D.33.6LNO2和足量水反应转移的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铁粉和铝粉的混合物逐渐加入100mL的稀硝酸中,其产生的有关离子浓度与加入铁粉和铝粉的混合物的质量的关系如下图所示:
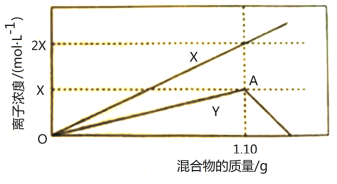
若反应过程中生成的气体为NO,溶液的体积变化忽略不计。请回答下列问题:
(1)X表示的变化离子是_______________(填离子符号)。
(2)OA段发生反应的离子方程式是___________________________________。
(3)稀硝酸溶解1.10g铁粉和铝粉后溶液还能继续溶解混合物的原因是________________
(4)该硝酸的浓度是_____________mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com