
【题目】设NA表示阿伏伽德罗常数的值,下列叙述正确的是
A.0.1mol Fe与100mL 1mol·L-1盐酸充分反应,溶液中的Fe2+数目为0.1NA
B.0.1mol·L-1(NH4)2SO4溶液中含SO42-数目为0.1NA
C.常温常压下,1.8g H2O中含有的分子数为0.1NA
D.33.6LNO2和足量水反应转移的电子数为NA
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】Co3O4(Co为+2和+3价)可应用于磁性材料等领域。实验室利用乙酸钴晶体[Co(CH3COO)2·4H2O]制备Co3O4的实验步骤如下:
Ⅰ. 将乙酸钴晶体配成溶液X,缓慢滴加(NH4)2CO3溶液,30 ℃水浴一段时间;
Ⅱ. 将混合液高压密封加热到160 ℃,得到含碱式碳酸钴晶体[2CoCO3·3Co(OH)2·H2O]的浊液;
Ⅲ. 制备碱式碳酸钴晶体;
Ⅳ. 将碱式碳酸钴晶体在空气中煅烧得Co3O4产品。
已知:碱式碳酸钴晶体不溶于冷水和乙醇,可溶于温水,常压下高于30 ℃开始分解。
(1) 乙酸钻晶体中钴含量可用配位滴定法测定,下列说法正确的是________(填字母)。
a. 滴定前,锥形瓶和滴定管均须用标准溶液润洗
b. 读数前,需排除滴定管尖嘴处的气泡
c. 滴定时,眼睛注视锥形瓶中颜色变化
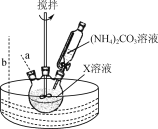
(2) “步骤Ⅰ”30 ℃水浴的装置如右图所示,温度计应置于________(填“a”或“b”)处。
(3) “步骤Ⅱ”采用高压密封加热的目的是________。
(4) “步骤Ⅳ”中,在实验室煅烧碱式碳酸钴晶体所需的仪器除酒精灯、三脚架以外,还需要的硅酸盐质仪器有____________,煅烧时发生反应的化学方程式为________。
(5) “步骤Ⅲ”中,设计由“步骤Ⅱ”的浊液制备碱式碳酸钴晶体的实验方案:________________________。(实验须使用的试剂:蒸馏水、乙醇)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL 0.05mol·L-1的某稀酸H2B溶液中滴入0.1mol·L-1氨水,溶液中由水电离出氢离子浓度随滴入氨水体积变化如图。下列分析正确的是

A.NaHB溶液可能为酸性,也可能为碱性
B.A、B、 C三点溶液的pH是逐渐减小,D、E、F三点溶液的pH是逐渐增大
C.B点溶液c(NH4+)=2c(B2-)
D.E溶液中离子浓度大小关系:c(NH4 +)> c(B2-)> c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像分别表示有关反应的反应过程与能量变化的关系,据此判断下列说法正确的是 ( )
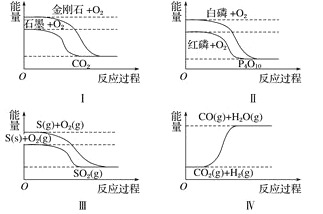
A.金刚石比石墨稳定
B.红磷转变为白磷是吸热反应
C.S(g)+O2(g) === SO2(g) ΔH1 ;S(s)+O2(g) === SO2(g) ΔH2,则ΔH1>ΔH2
D.CO(g)+H2O(g) === CO2(g)+H2(g) ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应X2(g)+Y2(g)![]() 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.2 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.2 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
A. Z为0.2 mol·L-1 B. Y2为0.35 mol·L-1
C. X2为0.3 mol·L-1 D. Z为0.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是被广泛应用的金属之一,铜器件在空气中久置会生成铜锈:
是被广泛应用的金属之一,铜器件在空气中久置会生成铜锈:![]() 。回答下列问题:
。回答下列问题:
(1)![]() 元素在元素周期表中的位置为________,基态
元素在元素周期表中的位置为________,基态![]() 原子的核外电子排布式为________,基态
原子的核外电子排布式为________,基态![]() 有________个未成对电子。
有________个未成对电子。
(2)参与生成铜锈的物质![]() 中
中![]() 原子的杂化方式为________,
原子的杂化方式为________,![]() 分子的空间构型是________。
分子的空间构型是________。
(3)![]() 的晶体类型是________,
的晶体类型是________,![]() 含________
含________![]() σ键。
σ键。
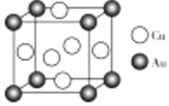
(4)![]() 、
、![]() 可形成金属互化物,其晶胞结构如图所示,若该
可形成金属互化物,其晶胞结构如图所示,若该![]() 、
、![]() 金属互化物的密度为
金属互化物的密度为![]() ,阿伏加德罗常数为
,阿伏加德罗常数为![]() ,则晶胞边长
,则晶胞边长![]() =________nm;
=________nm;
(5)金属铜单独与氨水或过氧化氢均不能反应,但可与过氧化氢和过量氨水的混合溶液反应生成一种配位化合物,其反应的化学方程式可表示为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如下图所示(图中的ΔH表示生成1 mol产物的数据)。
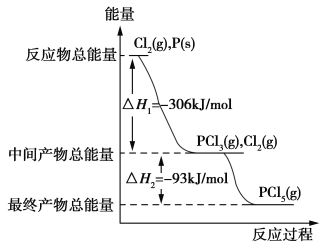
根据图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式为_____________________。
(2)PCl5分解成PCl3和Cl2的热化学方程式为_____________________。
(3)P和Cl2分两步反应生成1 mol PCl5的ΔH3=________,P和Cl2一步反应生成1 mol PCl5的ΔH4________(填“>”“<”或“=”)ΔH3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学向100mL NH4Al(SO4)2溶液中加入0.1 mol·L-1NaOH溶液,产生沉淀的图像如下:
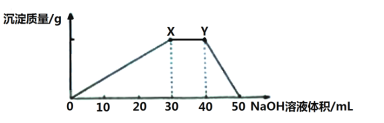
下列说法不正确的是
A.NH4Al(SO4)2溶液中含0.003 mol Al3+
B.NH4Al(SO4)2溶液中NH4+的浓度是0.01 mol·L-1
C.Al3+结合OH-的能力比NH4+强
D.Y点之后发生反应的离子方程式是:Al(OH)3+ OH-= AlO2-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关Na2CO3和NaHCO3的叙述中正确的是( )
A.Na2CO3比NaHCO3热稳定性强
B.相同质量的Na2CO3和NaHCO3与足量盐酸作用时,产生的气体质量相同
C.相同温度下,Na2CO3的溶解度小于NaHCO3
D.物质的量浓度相同时,Na2CO3溶液的pH比NaHCO3溶液的小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com