
【题目】实验室常用的几种气体发生装置如图A、B、C所示:
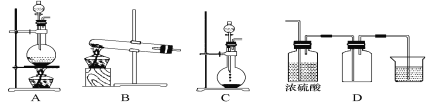
①实验室可以用B或C装置制取氨气,如果用C装置,通常使用的药品是___。
②气体的性质是气体收集方法选择的主要依据。下列性质与收集方法无关的是___(填序号,下同);
A.密度 B.颜色 C.溶解性 D.热稳定性 E.与氧气反应
③若用A装置与D装置相连制取并收集X气体,则X可能是下列气体中的___。
A.CO2 B.NO C.Cl2 D.H2
【答案】浓氨水、CaO固体(NaOH固体) BD C
【解析】
(1)、用B装置制备氨气为固体加热装置,用C装置制备氨气为固体与液体不需要加热装置;
(2)、收集气体的方法的选择可依据气体的密度和溶解性,如气体与氧气反应则只能用排水法收集;结合密度可选择向下或向上排空气法收集;
(3)、若用A装置与D装置相连制取并收集X气体,为固体与液体反应需要加热装置,且气体可利用浓硫酸干燥、向上排空气法收集,需要尾气处理,以此来解答。
(1)、用B装置制备氨气为固体加热装置,选择药品为氢氧化钙固体和氯化铵固体;用C装置制备氨气为固体与液体不需要加热装置,选择药品为浓氨水和氧化钙(或碱石灰、固体氢氧化钠等),故答案为:浓
氨水和氧化钙(或碱石灰、固体氢氧化钠等) ;
(2)、收集气体的方法的选择可依据气体的密度和溶解性,如气体与氧气反应则只能用排水法收集,气体是否有颜色、热稳定性与收集方法无关,故答案为:BD;
(3)、若用A装置与D装置相连制取并收集X气体,为固体与液体反应需要加热装置,且气体可利用浓硫酸干燥、向上排空气法收集,需要尾气处理,符合条件的只有氯气,故答案为:C。


科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是工业盐的主要成分,在漂白、电镀等方面应用广泛。实验室利用下图装置制备亚硝酸钠,并测定所制亚硝酸钠的纯度。(加热装置及部分夹持装置已略去)
Ⅰ.亚硝酸钠的制备。
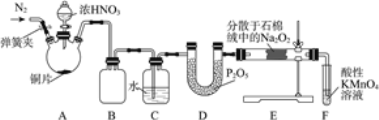
(1)盛放浓HNO3的仪器的名称为__________;装置B的作用是______________。
(2)装置E中制取NaNO2的化学方程式为___________________。
(3)多余的NO在装置F中被氧化为NO3-,反应的离子方程式为_____________。
(4)实验结束后打开A中弹簧夹,通入N2的目的是_______________。
Ⅱ.亚硝酸钠纯度的测定。
当Na2O2完全反应后,E中产生的固体除NaNO2外,还可能有NaNO3。测定亚硝酸钠纯度的步骤如下:
步骤一:取反应后的固体4.30 g溶于稀硫酸,向所得溶液中加入足量KI,将溶液中的NO2-和NO3-全部还原为NO,并通入足量N2,将NO全部赶出,最后将溶液稀释至1000 mL。
步骤二:取上述所得溶液10 mL,用淀粉作指示剂,用0.050 mol/L的Na2S2O3标准液滴定,发生的反应为I2+2Na2S2O3=2NaI+Na2S4O6,最终消耗Na2S2O3溶液体积为16.00 mL。
(5)步骤二中达到滴定终点的标志为______________________。
(6)混合固体中NaNO2的质量分数为________。(保留三位有效数字)
(7)若在滴定终点读取滴定管刻度时,仰视标准液液面,则测得亚硝酸钠的纯度________。(填“偏高”“偏低”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酰水杨酸(阿司匹林)是目前常用药物之一。实验室通过水杨酸进行乙酰化制备阿司匹林的一种方法如下:
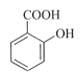 +(CH3CO)2O
+(CH3CO)2O![]()
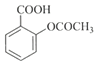 +CH3COOH
+CH3COOH
水杨酸 酸酐 乙酰水杨酸
水杨酸 | 醋酸酐 | 乙酰水杨酸 | |
熔点/℃ | 157~159 | -72~74 | 135~138 |
相对密度/(g/cm3) | 1.44 | 1.10 | 1.35 |
相对分子质量 | 138 | 102 | 180 |
实验过程:在100 mL锥形瓶中加入水杨酸6.9 g及醋酸酐10 mL,充分摇动使固体完全溶解。缓慢滴加0.5 mL浓硫酸后加热,维持瓶内温度在70℃左右,充分反应。稍冷后进行如下操作:
①在不断搅拌下将反应后的混合物倒入100 mL冷水中,析出固体,过滤。
②所得结晶粗品加入50 mL饱和碳酸氢钠溶液,溶解、过滤。
③滤液用浓盐酸酸化后冷却、过滤得固体。
④固体经纯化得白色的乙酰水杨酸晶体5.4 g。
回答下列问题:
(1)该合成反应中最好采用__________加热(填标号)。
A. 酒精灯 B.热水浴 C.煤气灯 D.电炉
(2)下列玻璃仪器中,①中需使用的有________(填标号)。
(3)①中需使用冷水,目的是_________________________。
(4)②中的主要化学反应方程式是:____________________。
(5)④采用的纯化方法为____________。
(6)本实验的产率为_________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
①SO2、CS2、HI都是直线形的分子 ②价电子排布式为ns2的原子属于ⅠA或ⅡA族元素 ③Ge是ⅣA族的一种元素,其核外电子排布式为:[Ar]4s24p2,属于P区元素 ④非极性分子往往是高度对称的分子,比如BF3,PCl5,H2O2,CO2这样的分子⑤化合物NH4Cl和CuSO4·5H2O都存在配位键 ⑥AgCl是一种白色的沉淀,不溶于硝酸、浓硫酸、烧碱溶液,却能溶于氨水中 ⑦已知熔融状态的HgCl2不能导电,HgCl2的稀溶液有弱的导电能力且可作手术刀的消毒液,则从不同角度分类HgCl2是一种共价化合物、非电解质、盐、分子晶体 ⑧氨水中大部分NH3与H2O以氢键(用“…”表示)结合成NH3·H2O分子,根据氨水的性质可知NH3·H2O的结构式为![]()
A.①③B.②④C.⑤⑥D.⑤⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一化合物的分子式为AB2,A属ⅥA族元素,B属ⅦA族元素,A和B在同一周期,它们的电负性值分别为3.44和3.98,已知AB2分子的键角为103.3。。下列推断不正确的是( )
A.AB2分子的空间构型为“V”形
B.A---B键为极性共价键,AB2分子为非极性分子
C.AB2与H2O相比,AB2的熔点、沸点比H2O的低
D.AB2分子中无氢原子,分子间不能形成氢键,而H2O分子间能形成氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Deacon发明将氯化氢直接转化为氯气:4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g) ΔH。下图为恒容密闭容器中,进料浓度比c(HCl)∶c(O2)分别等于1∶1、4∶1、7∶1时,HCl平衡转化率随温度变化的关系。下列说法正确的是
2Cl2(g)+2H2O(g) ΔH。下图为恒容密闭容器中,进料浓度比c(HCl)∶c(O2)分别等于1∶1、4∶1、7∶1时,HCl平衡转化率随温度变化的关系。下列说法正确的是
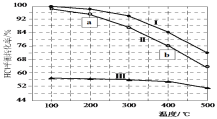
A.ΔH> 0
B.正反应速率v正(a)<v正(b)
C.曲线Ⅲ进料浓度比c(HCl)∶c(O2)等于1:1
D.若HCl初始浓度为c0,按曲线Ⅰ计算K(400℃),表达式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实,不能用勒夏特列原理解释的是
A. 氨水中加酸,NH4+ 的浓度增大
B. 装有NO2和N2O4平衡的混合气体的玻璃球在冷水中气体颜色变浅
C. 实验室中常用排饱和食盐水的方法收集Cl2
D. H2、I2、HI的体系平衡后,加压混合气体颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将 4 molA 和 2 molB 在 2 L 的容器中混合并在一定条件下发生如下反应 2A(g)+B(s)=2C(g),若经2s后测得 C 的浓度为 0.6 mol/L,现有下列几种说法:
①用物质 A 表示的反应的平均速率为 0.3 mol/(L·s)
②用物质 B 表示的反应的平均速率为 0.6 mol/(L·s)
③增大 B 的浓度可加快反应速率
④2 s 时物质 A 的浓度为 1.4 mol/L
其中正确的是
A.①③B.①④C.②③D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃组成的混合气体完全燃烧后所得到CO2和H2O的物质的量随混合烃总物质的量的变化如图所示,下列有关混合气体的说法正确的是( )
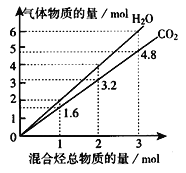
A.该混合气体中一定含有乙烯
B.该混合气体一定含有甲烷和乙炔
C.在110℃条件下,混合气体与氧气混合,总混合气燃烧前后压强不变
D.若混合气体由CH4和C2H4组成,则其体积比为1:3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com