
【题目】现有A、B、C、D四种元素,其原子序数依次递增.已知,A、C为短周期非金属元素,其单质在常温下均为气体,两单质混合见光爆炸生成AC,AC溶液显强酸性.B、D为金属元素,B的原子序数为D的一半,D与C2和AC溶液反应分别得DC3和DC2 , 烧碱溶液不能与D单质反应,而能与B单质反应.请回答下列问题:
(1)C的原子结构示意图为;B在周期表中的位置是 。
(2)用电子式表示AC的形成过程 。
(3)写出B单质与NaOH溶液反应的离子方程式 。
(4)电浮选凝聚法是工业上采用的一种污水处理方法,右图是该方法处理污水的实验装置示意图(B、D金属单质作电极).实验过程中,污水的pH始终保持在5.0~6.0之间.接通电源后,阴极产生的气体将污物带到水面形成浮渣而刮去,起到浮选净化作用;阳极产生的沉淀具有吸附性,吸附污物而沉积,起到凝聚净化作用.阳极的电极反应有两个,分别是2H2O-4e-=4H++O2↑和 。阳极区生成沉淀的离子方程式是。 
(5)一定条件下,2mol B与3mol D的氧化物W恰好反应,则W的化学式。
【答案】
(1)Cl ;第三周期第IIIA族
(2)
(3)2Al+2OH-+2H2O=2AlO2-+3H2↑
(4)Fe-2e-=Fe2+;4Fe2++10H2O+O2=4Fe(OH)3↓+8H+
(5)FeO
【解析】(1)短周期非金属元素,其单质在常温下为气体有:H2、N2、O2、F2、Cl2 , 根据题意,A、C两单质混合见光爆炸生成AC,混合见光爆炸是H2和Cl2的特征反应,结合原子序数依次递增,则可确定A是H元素,单质是H2 , C是Cl元素,单质是Cl2 . 化合物AC为HCl.D与C2和AC溶液反应分别得DC3和DC2 , 即D与Cl2和HCl溶液反应分别得DCl3和DCl2 , 可分析出金属D化合价具有+2、+3价,确定出D为Fe元素.Fe的原子序数为26,则B的原子序数为13,即B为Al元素.C是Cl,Cl的原子序数=核电荷数=核外电子数=17,故原子示意图为 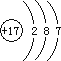 ,B是Al,Al的原子序数=13,原子核外有3个电子层,最外层排布3个电子,根据电子层数=周期数,最外层电子数=主族序数,可得Al在周期表中位置为第三周期、第IIIA族。(2)AC为化合物HCl,用电子式表示形成过程时,反应物用原子的电子式表示,生成物用化合物的电子式表示,符号用“→”符号,故表示为
,B是Al,Al的原子序数=13,原子核外有3个电子层,最外层排布3个电子,根据电子层数=周期数,最外层电子数=主族序数,可得Al在周期表中位置为第三周期、第IIIA族。(2)AC为化合物HCl,用电子式表示形成过程时,反应物用原子的电子式表示,生成物用化合物的电子式表示,符号用“→”符号,故表示为 ![]() 。(3)B单质是Al,根据铝的性质,与NaOH溶液反应时有水参与,生成偏铝酸钠和氢气,反应为Al+NaOH+H2O→NaAlO2+H2↑,根据化合价升降法配平,Al由0价上升到+3价,上升3价,H2中H由+1价降低为0价,总共降低2价,所以Al前面计量数为2,H2前面计量数为3,其它物质前计量数根据原子守恒配平即得方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑,改写离子方程式时Al、H2是单质保留化学式,H2O是弱电解质保留化学式,NaOH和NaAlO2是易溶于水、易电离物质改成离子形式,再删除不参与离子反应的Na+ , 即得离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑。(4)根据题意,电解池的阳极材料为Fe,阴极材料为Al.金属作阳极时,电极称为活性电极,由于金属失电子能力强于溶液中的阳离子,所以阳极上是活性电极自身先失去电子.电解池的阳极放电顺序是:活性电极>Ag+>Hg2+>Fe3+>Cu2+>H+等,因此阳极的另一个电极反应为Fe-2e-=Fe2+ . 生成的Fe2+进入溶液中,溶液中Fe2++2OH-═Fe(OH)2↓,来自水的电离H2O
。(3)B单质是Al,根据铝的性质,与NaOH溶液反应时有水参与,生成偏铝酸钠和氢气,反应为Al+NaOH+H2O→NaAlO2+H2↑,根据化合价升降法配平,Al由0价上升到+3价,上升3价,H2中H由+1价降低为0价,总共降低2价,所以Al前面计量数为2,H2前面计量数为3,其它物质前计量数根据原子守恒配平即得方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑,改写离子方程式时Al、H2是单质保留化学式,H2O是弱电解质保留化学式,NaOH和NaAlO2是易溶于水、易电离物质改成离子形式,再删除不参与离子反应的Na+ , 即得离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑。(4)根据题意,电解池的阳极材料为Fe,阴极材料为Al.金属作阳极时,电极称为活性电极,由于金属失电子能力强于溶液中的阳离子,所以阳极上是活性电极自身先失去电子.电解池的阳极放电顺序是:活性电极>Ag+>Hg2+>Fe3+>Cu2+>H+等,因此阳极的另一个电极反应为Fe-2e-=Fe2+ . 生成的Fe2+进入溶液中,溶液中Fe2++2OH-═Fe(OH)2↓,来自水的电离H2O ![]() H++OH- , Fe(OH)2易被氧气氧化,反应为4Fe(OH)2+O2+2H2O═4Fe(OH)3↓,上述三步反应合并即得总反应为4Fe2++10H2O+O2=4Fe(OH)3↓+8H+。(5)根据题意,B单质是Al,D为Fe,2molAl与3molFe的氧化物反应为铝热反应,生成Fe和铝的氧化物,依据原子守恒,2molAl生成1molAl2O3 , 1molAl2O3中共含有3mol氧原子,3mol氧原子只能来自于3molFe的氧化物中,因此Fe的氧化物中只含一个氧原子,反应方程式为2Al+3FeO
H++OH- , Fe(OH)2易被氧气氧化,反应为4Fe(OH)2+O2+2H2O═4Fe(OH)3↓,上述三步反应合并即得总反应为4Fe2++10H2O+O2=4Fe(OH)3↓+8H+。(5)根据题意,B单质是Al,D为Fe,2molAl与3molFe的氧化物反应为铝热反应,生成Fe和铝的氧化物,依据原子守恒,2molAl生成1molAl2O3 , 1molAl2O3中共含有3mol氧原子,3mol氧原子只能来自于3molFe的氧化物中,因此Fe的氧化物中只含一个氧原子,反应方程式为2Al+3FeO ![]() Al2O3+3Fe,即D的氧化物W为FeO。
Al2O3+3Fe,即D的氧化物W为FeO。


科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成碳族元素中C与Si的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律。A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸。已知常温下浓盐酸与高锰酸钾能反应生成氯气。

(1)甲同学设计实验的依据是____________________________;写出对应装置中选用的物质:A_________,B__________,C___________;其中装置B中所盛试剂的作用为_____________;C中反应的离子方程式为___________________。
(2)乙同学的实验原理是_____________________________________;写出B处的离子方程式:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某制糖厂以甘蔗为原料制糖,同时得到大量的甘蔗渣,对甘蔗渣进行综合利用不仅可以提高综合效益,而且还能防止环境污染,生产流程如下:

已知石油列解已成为生产H的重要方法,E的溶液能发生银镜反应,G是具有香味的液体,试填空。
(1)A的名称______;G的名称______。
(2)B的结构简式_______;H的结构简式____________。
(3)写出H发生加聚反应的方程式:_____________。
(4)D→E的化学方程式:_____________。
(5)E→F的化学方程式:_____________。
(6)F→G的化学方程式:_____________。
(7)写出G的同分异构体中与CH3COOH互为同系物的结构简式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上处理含Cr2O![]() 的酸性工业废水用以下方法:
的酸性工业废水用以下方法:
①往工业废水中加入适量的NaCl,搅拌均匀;②用Fe为电极进行电解,经过一段时间有Cr(OH)3和Fe(OH)3沉淀生成;③过滤回收沉淀,废水达排放标准。试回答:
(1)电解时的电极反应,阳极 , 阴极。
(2)写出Cr2O![]() 转变成Cr3+的离子反应方程式。
转变成Cr3+的离子反应方程式。
(3)电解过程中Cr(OH)3和Fe(OH)3沉淀是怎样产生的?。
(4)能否将Fe电极改成石墨电极?为什么?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2NO2![]() 2NO+O2在密闭容器中反应,达到平衡状态的标志是( )
2NO+O2在密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
A. ①④ B. ②③
C. ①③④ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,某容积固定的密闭容器中,建立下列化学平衡:C(s)+H2O(g)![]() CO(g)
CO(g)
+H2(g)。下列叙述中不能说明上述可逆反应已达到化学平衡状态的是( )
A. 体系的压强不再发生变化
B. v正(CO)=v逆(H2O)
C. 生成n mol CO的同时生成n mol H2
D. 1 mol H—H键断裂的同时断裂2 mol H—O键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质.
(1)基态硅原子的电子排布式
(2)有一类组成最简单的有机硅化合物叫硅烷.硅烷的组成、结构与相应的烷烃相似.硅烷中硅采取 杂化方式,硅烷的沸点与相对分子质量的关系如图所示,呈现这种变化的原因是 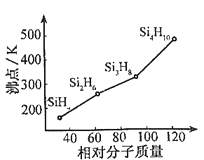
(3)硒和硫同为VIA族元素,与其相邻的元素有砷和溴,则三种元素的电负性由小到大的顺序为 .(用元素符号表示)
(4)气态SeO3分子的立体构型为 ,与SeO3互为等电子体的一种离子为 (填化学式).
(5)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中金原子(Au)与铜原子(Cu)个数比为 ;若该晶体的晶胞棱长为a pm,则该合金密度为 g/cm3 . (列出计算式,不要求计算结果,阿伏伽德罗常数的值为NA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R、W均为周期表中前四周期的元素,其原子序数依次增大;X2﹣和Y+有相同的核外电子排布;Z的氢化物的沸点比其上一周期同族元素氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气态单质.回答下列问题(相关回答均用元素符号表示):
(1)R的基态原子的核外电子排布式是 .
(2)Z的氢化物的沸点比其上一周期同族元素氢化物的沸点低的原因是 .
(3)X与Z中电负性较大的是 . Z的某种含氧酸盐常用于实验室中X的单质的制取,此酸根离子的空间构型是 , 此离子中含有的化学键类型是 , X﹣Z﹣X的键角109.5°.(填“>”“=”或“<”)(提示:孤电子对之间的斥力>孤电子对与成键电子对之间的斥力>成键电子对之间的斥力).
(4)X与Y形成的化合物Y2X的晶胞如图.其中X离子的配位数为 , 以相距一个X离子最近的所有Y离子为顶点构成的几何体为 . 该化合物与MgO相比,熔点较高的是 . 
(5)已知该化合物的晶胞边长为a pm,则该化合物的密度为gcm﹣3 . (只要求列算式,不必计算出数值,阿伏加德罗常数的数值为NA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制0.2 mol·L-1的NaCl溶液,下列操作会导致所配溶液的物质的量浓度偏高的是
A. 称量时,左盘高,右盘低 B. 定容时俯视读取刻度
C. 原容量瓶洗净后未干燥 D. 转移溶液时未洗涤烧杯2~3次
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com