
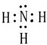 ,故答案为:
,故答案为: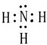 ;
;| 0.06mol |
| 0.1L |


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:
| A、NH4+、Ca2+、SO42-、CO32- |
| B、Fe3+、H+、I-、HCO3- |
| C、K+、Na+、H+、NO3-、MnO4- |
| D、Al3+、Mg2+、SO42-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:

| C(H+) |
| C(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.01mol?L-1 NH4Al(SO4)2溶液与0.02mol?L-1 Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3?H2O |
| B、一定条件下,将0.5mol N2(g)和1.5mol H2(g)置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为: N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ?mol-1 |
| C、溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+═AgBr↓ |
| D、CO(g)的燃烧热是283.0kJ?mol-1,则CO2分解的热化学方程式为:2CO2(g)═2CO(g)+O2(g)△H=+283.0kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用酒精萃取碘水中的碘 |
| B、少量钠可用铝箔包裹,密封保存在广口瓶中 |
| C、CO2水溶液能导电,是因为CO2是电解质;CaCO3难溶于水,CaCO3是非电解质 |
| D、铝箔在空气中受热可以熔化,由于氧化膜的存在,熔化的铝并不滴落 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com