
【题目】下列有关生物体内水和无机盐的叙述正确的是( )
A. 不同种生物细胞的自由水和结合水的比值相同,它们的代谢强度也相同
B. 癌变细胞和衰老细胞内的水分减少,新陈代谢速率减慢
C. 给水中毒患者注射质量分数为1.8%的盐水,是为了降低细胞外液的渗透压
D. 血浆pH能维持相对稳定,与它含有的HCO、HPO等离子有关
科目:高中化学 来源: 题型:
【题目】物质分类是化学研究的重要方法之一。近年来发现,在金星大气层中存在三氧化二碳。下列物质与它属于同类的是
A.SO2、NO B.H2SO4、H2CO3
C.H2、O3 D.Na2SO3、KClO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在强酸性溶液中能大量共存且溶液为无色透明的一组离子的是
A.Cu2+、Na+、CO32-、SO42-
B.K+、Cl-、Na+、SO42-
C.Na+、NO3-、HCO3-、K+
D.Fe2+、MnO4-、Cl-、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关酶的叙述,正确的是
A. 酶的基本组成单位酸或脱氧核苷酸 B. 酶为反应过程供能从而降低反应活化能
C. 酶在活细胞以外不具有催化活性 D. 酶可以是其他酶促反应的的底物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、铜单质及其化合物应用范围很广。现有含氯化亚铁杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的 CuCl2·2H2O,首先将其制成水溶液,然后按如图步骤进行提纯:

已知Cu2+、 Fe3+和 Fe2+的氢氧化物开始沉淀和沉淀完全时的 pH,见下表:
Fe3+ | Fe2+ | Cu2+ | |
氢氧化物开始沉淀时的 pH | 1.9 | 7.0 | 4.7 |
氢氧化物完全沉淀时的 pH | 3.0 | 9.0 | 6.7 |
请回答下列问题:
(1)常温下,计算Fe(OH)3的溶度积Ksp=________(通常认为残留在溶液中的离子浓度小于1×10-5 mol/L 时则沉淀完全。)
(2)加入氧化剂的目的______________________。
(3)最适合作氧化剂X的是__________。
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(4)加入的物质 Y 是____________。
(5)若向溶液Ⅱ中加入碳酸钙,产生的现象是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应不属于氧化还原反应的是( )
A.Al(OH)3+3HCl==AlCl3+3H2O B.3Fe+4H2O(g)==Fe3O4+4H2
C.3NO2+H2O==2HNO3+NO D.Cl2+H2O==HCl+HclO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现:一节电池烂在地里,能够使一平方米的土地失去利用价值。废旧电池的危害上要集中在其中所含的少量重金属上。将废旧锌锰电池回收处理,既能减少它对环境的污染,又能实现废电池的资源化利用。
(1)回收填料中的二氧化锰和氯化铵。已知:废旧干电池填料的主要成分为二氧化锰、炭粉、氯化铵和氯化锌等,其中氯化铵、氯化锌可溶于水。回收物质的流程如图所示。
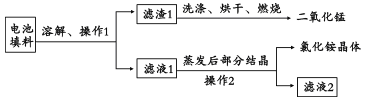
① 操作中先将电池填料研碎的目的是:________________。
② 操作l和操作2的名称都是___________,该操作中玻璃棒的作用是___________。
③ 灼烧滤渣l的目的是______________________。
(2)回收二氯化锰:将废旧锌锰电池处理,得到含锰混合物,向该混合物加入浓盐酸并加热。
①写出MnOOH与浓盐酸反应的化学方程式:________________。
② 锰回收新方法:向废旧锌锰电池内的混合物[主要成分MnOOH、Zn(OH)2]中加入一定量的稀硫酸和稀草酸(H2C2O4),并不断搅拌至无CO2产生为止,写出MnOOH参与反应的化学方程式______________。与使用浓盐酸回收锰相比,新方法的优点是___________(答l点即可)。
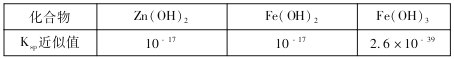
(3)用废电池的锌皮可用于回收制作ZnSO4·7H2O。过程中,需除去锌皮中的少量杂质铁,其方法是:常温下,加入稀H2SO4和H2O2,铁溶解变为Fe3+,加碱调节pH为4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中c(Fe3+)=_________。继续加碱调节pH为____时,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。部分难溶的电解质溶度积常数(Ksp)如下表:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素的单质及化合物(或溶液)的转化关系:
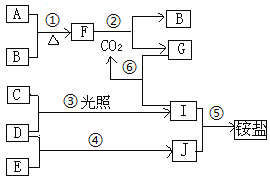
已知B、C、D、E是非金属单质,且在常温下都是气体;化合物G的焰色反应为黄色,化合物I、J通常状况下呈气态;反应④是化工生产中的一种重要固氮反应。请回答下列问题:
(1)写出A、B元素在周期表中的位置:A__________________ B__________________
(2)①~⑥反应中属于氧化还原反应的是 ___________________________________(填序号)
(3)写出②的化学方程式: _____________________________
⑥的离子方程式:______________________________________
(4)反应⑤的现象是________,J的另一种检验方法及现象是_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com