
【题目】(1)下表是几种常见弱酸的电离平衡常数(25℃)
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
①根据分析表格中数据可知,H2CO3、CH3COOH、HClO三种酸的酸性从强到弱依次是___;下列反应不能发生的是___(填字母)。
a.CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O
b.CO32-+2HClO=CO2↑+H2O+2ClO-
c.ClO-+CH3COOH=CH3COO-+HClO
d.2ClO-+CO2+H2O=CO32-+2HClO
②碳酸钠溶液中各离子浓度从大到小的顺序依次为:___。
(2)体积均为10 mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000 mL,稀释过程中pH变化如图所示。稀释后,HX溶液中水电离出来的c(H+)__(填“>”、“=”或“<”)醋酸溶液中水电离出来的c(H+);

(3)25℃时,向50mL0.018mol·L-1的AgNO3溶液中加入50mL0.020mol·L-1的盐酸生成沉淀。已知该温度下AgCl的Ksp=1.0×10-10,忽略溶液混合后体积的变化,请计算:
①完全沉淀后,溶液中c(Ag+)=__mol·L-1。
②完全沉淀后,溶液的pH=__。
【答案】CH3COOH>H2CO3>HClO b、d c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+) > 1.0×10-7mol·L-1 2
【解析】
(1)①分析表格中数据可知,电离常数CH3COOH>H2CO3>HClO,由此可得出三种酸的酸性顺序。
a.K(CH3COOH)> K1(H2CO3),反应CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O能发生;
b.K(HClO)<K1(H2CO3),反应CO32-+2HClO=CO2↑+H2O+2ClO-不能发生;
c.K(CH3COOH)> K(HClO),反应ClO-+CH3COOH=CH3COO-+HClO能发生;
d.K2(H2CO3)<K(HClO)\,则反应2ClO-+CO2+H2O=CO32-+2HClO不能发生。
②碳酸钠溶液中各离子浓度关系,可通过写出电离、水解方程式进行分析。
(2)从图中可以看出,稀释后HX的pH大,则溶液中的c(OH-)大,水的电离程度大,从而可确定HX溶液中水电离出来的c(H+)与醋酸溶液中水电离出来的c(H+)的关系;
(3)①完全沉淀后,先求出溶液中c(Cl-),再利用AgCl的Ksp=1.0×10-10,求出c(Ag+)。
②完全沉淀后,H+未参加反应,求出溶液中的c(H+),最后求溶液的pH。
(1)①分析表格中数据可知,电离常数CH3COOH>H2CO3>HClO,由此可得出三种酸从强到弱依次是CH3COOH>H2CO3>HClO;下列反应不能发生的是b、d。答案为:CH3COOH>H2CO3>HClO;b、d;
a.K(CH3COOH)> K1(H2CO3),反应CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O能发生;
b.K(HClO)<K1(H2CO3),反应CO32-+2HClO=CO2↑+H2O+2ClO-不能发生;
c.K(CH3COOH)> K(HClO),反应ClO-+CH3COOH=CH3COO-+HClO能发生;
d.K2(H2CO3)<K(HClO)\,则反应2ClO-+CO2+H2O=CO32-+2HClO不能发生。
②在碳酸钠溶液中发生如下反应:Na2CO3=2Na++CO32-、CO32-+H2O![]() HCO3-+OH-、
HCO3-+OH-、
HCO3-+H2O![]() H2CO3+OH-、H2O
H2CO3+OH-、H2O![]() H++OH-,且程度由强到弱,则离子浓度由大到小的顺序为c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)。答案为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+);
H++OH-,且程度由强到弱,则离子浓度由大到小的顺序为c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)。答案为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+);
(2)从图中可以看出,稀释后HX的pH大,则溶液中的c(OH-)大,水的电离程度大,则HX溶液中水电离出来的c(H+)>/span>醋酸溶液中水电离出来的c(H+)。答案为:>;
(3)①完全沉淀后,溶液中c(Cl-)=![]() =0.001mol/L,再利用AgCl的Ksp=1.0×10-10,求出c(Ag+)=
=0.001mol/L,再利用AgCl的Ksp=1.0×10-10,求出c(Ag+)=![]() =1.0×10-7mol/L。
=1.0×10-7mol/L。
②完全沉淀后,H+未参加反应,溶液中的c(H+)=![]() =0.01mol/L,溶液的pH=-lgc(H+)=2。答案为:1.0×10-7mol·L-1;2。
=0.01mol/L,溶液的pH=-lgc(H+)=2。答案为:1.0×10-7mol·L-1;2。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】反应2H2(g)+02(g)=2H2O(l)过程中的能量变化如图所示,下列有关说法中正确的是

A. H1<0 B. H2为该反应的反应热
C. H3为氢气的燃烧热 D. H1=H3-H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4-CO2催化重整时发生反应:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g),不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
2CO(g)+2H2(g),不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
(1)某温度下,向1L的密闭容器中充入0.2molCH4与0.1molCO2,发生CH4-CO2催化重整反应,10min时达到平衡,测得平衡混合物中CO(g)的体积分数为20%,则用CH4表示的反应速率为______,CO2的平衡转化率为______。
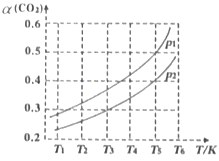
(2)若CO2的平衡转化率(a)与温度(T)、压强(p)的关系如图所示。由图可知:压强p1______p2(选填“>“、“<“或“=”),理由是______。
(3)在一定温度下,向固定容积为2L的密闭容器中充入0.1moCH4与0.1mo1CO2发生CH4-CO2催化重整反应,达平衡时CO2的平衡转化率为50%,则此条件下该反应的平衡常数为K=______;平衡后保持温度不变,若再充入0.15molCH4、0.15molCO2、0.1molCO、0.1molH2,则此时v正______(选填“>”、“<”或“=”)v逆。
(4)已知:C(s)+2H2(g)=CH4(g)△H1=-75 kJmol-1
C(s)+O2(g)=CO2(g)△H2=-394 kJmol-1
C(s)+![]() O2(g)=CO(g)△H3=-111 kJmol-1
O2(g)=CO(g)△H3=-111 kJmol-1
①催化重整反应CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)的△H=______kJmol-1。
2CO(g)+2H2(g)的△H=______kJmol-1。
②反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表:
积碳反应CH4(g)=C(s)+2H2(g) | 消碳反应CO2(g)+C(s)=CO(g) | ||
△H/(kJmol-1) | 75 | 172 | |
活化能/(kJmol-1) | 催化剂X | 33 | 91 |
催化剂Y | 43 | 72 | |
由上表判断,催化剂X______Y(填“优于”或“劣于”),理由是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能够跟1mol ![]() 起反应的Br2或H2的最大用量分别是
起反应的Br2或H2的最大用量分别是
A.1mol,1molB.3.5mol,7mol
C.1mol,7molD.6mol,7mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或对实验事实的描述中,正确的是 ______ ![]() 填序号
填序号![]() .
.
①为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化
②化学药品着火,都要立即用水或泡沫灭火器灭火
③配制一定物质的量浓度的稀硫酸溶液时,量取浓硫酸后的量筒要用蒸馏水洗涤,并把洗涤液转入容量瓶中
④配制一定物质的量浓度的溶液定容时,俯视容量瓶的刻线,会使配制的浓度偏高
![]() 向溶液中加入盐酸酸化的
向溶液中加入盐酸酸化的![]() 溶液,产生白色沉淀,说明一定含有
溶液,产生白色沉淀,说明一定含有![]()
⑥检验红砖中的红色物质是否是![]() 的操作步骤为:样品
的操作步骤为:样品![]() 粉碎
粉碎![]() 加水溶解
加水溶解![]() 过滤
过滤![]() 向滤液中滴加KSCN溶液.
向滤液中滴加KSCN溶液.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P akJ·mol—1、P—O bkJ·mol—1、P="O" ckJ·mol—1、O="O " dkJ·mol—1。

根据图示的分子结构和有关数据估算该反应的△H,其中正确的是( )
A. (6a+5d-4c-12b)kJ·mol—1B(4c+12b-6a-5d)kJ·mol—1 B. (4c+12b-4a-5d)kJ·mol—1
C. (4a+5d-4c-12b)kJ·mol—1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的前四周期元素,X、Z的周期序数=族序数,由这四种元素组成的单质或化合物存在如图所示的转化关系,其中甲、戊是两常见的金属单质,丁是非金属单质,其余为氧化物且丙为具有磁性的黑色晶体。下列说法正确的是

A.丙属于碱性氧化物
B.W元素在周期表中的位置是第四周期VIIIB族
C.W的原子序数是Z的两倍,金属性弱于Z
D.常温下等物质的量的甲和戊加入过量浓硝酸中,消耗的HNO3物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是光合作用过程的图解,图中甲、乙、丙、丁表示能量或物质,①、②表示过程。据图回答:
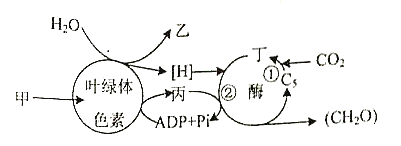
(1)甲表示__________,它可转变为储存在丙中的__________。
(2)物质乙是__________,美国科学家鲁宾和卡门利用同位素标记法进行探究,证明了光合作用产生的乙全部来自__________。
(3)物质丁是__________,过程①叫做__________,过程②所需的还原剂是图中的__________。突然停止光照,短时间内叶绿体中C5的含量__________(填“增加”“不变”或“减少”)。
(4)写出光合作用的总反应式:______________________________。
(5)植物光合作用强度受多种环境因素的影响。冬季蔬菜大棚主要是通过改变__________来提高光合作用强度。为提高蔬菜产童,菜农常向大棚内施加有机肥以增加__________和__________的供应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】10 ℃加热NaHCO3饱和溶液,测得该溶液的pH发生如下的变化:
温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50 ℃ |
pH | 8.3 | 8.4 | 8.5 | 8.8 |
(1)甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强,该水解反应的离子方程式为______________。
(2)乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度________(填“大于”或“小于”)NaHCO3,该分解反应的化学方程式为____。
(3)丙同学认为甲、乙的判断都不充分。丙认为:
①只要在加热煮沸的溶液中加入足量的试剂BaCl2溶液,若产生沉淀,则乙判断正确。原因是____________(写出反应的离子方程式)。能不能选用Ba(OH)2溶液?______(答“能”或“不能”)。
②将加热后的溶液冷却到10 ℃,若溶液的pH________(填“大于”“小于”或“等于”)8.3,则________(填“甲”或“乙”)判断正确。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com