
把一定质量的铁完全溶解于某浓度的硝酸中收集到0.3 mol NO2和0.2 mol NO。向反应后的溶液中加入足量NaOH溶液充分反应,经过滤、洗涤后,把所得沉淀加热至质量不再减少为止。得到固体质量不可能为
| A.18 g | B.24 g | C.30 g | D.36 g |
A
解析试题分析:根据题意可知在反应过程中Fe失去的电子与硝酸得到的电子的物质的量相等。最后所得到的固体为Fe2O3.n(e-)="0.3mol×1+0.2" mol×3=0.9mol.若Fe全部为+2价,则n(Fe)=0.45mol,根据Fe元素守恒,m(Fe2O3)= (0.45mol÷2)×160g/mol=36g,若Fe全部为+3价,则n(Fe)="0.3mol." m(Fe2O3)= (0.3mol÷2)×160g/mol=24g,若Fe被氧化的价态为+2、+3两种价态,则最后得到的固体的质量在36g—24g之间。因此最后得到固体质量不可能为18g.选项为A.
考点:考查极值法在Fe和HNO3反应的计算中的应用的知识。


科目:高中化学 来源: 题型:单选题
新型陶瓷材料氮化硅(Si3 N4)可以通过以下反应制得:3SiO2+6C+2N2 Si3N4+6CO,下列就该反应的分析错误的是
Si3N4+6CO,下列就该反应的分析错误的是
| A.压强增大,平衡向逆反应方向移动 |
| B.SiO2是氧化剂,CO是氧化产物 |
| C.上述反应若为放热反应,升高温度,平衡常数将减小 |
| D.上述反应中每生成1 molSi3N4,氮元素得12mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
新型净水剂—高铁酸钾(K2FeO4)为暗紫色固体,可溶于水。工业上制备K2FeO4的常用方法之一是次氯酸盐氧化法:①2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O、②Na2FeO4+2KOH=K2FeO4+2NaOH。下列说法不正确的是
| A.反应①为氧化还原反应,反应②为复分解反应 |
| B.反应①中氧化产物与还原产物物质的量之比为2:9 |
| C.反应②的产物K2FeO4中Fe为+6价,具有强氧化性,能杀菌消毒 |
| D.若有2mol FeCl3发生反应,转移电子的物质的量为6 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某离子反应中涉及H2O、ClO—、NH4+、H+、N2、Cl—六种微粒。其中N2的物质的量随时间变化的曲线如图所示。下列判断正确的是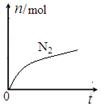
| A.该反应的还原剂是Cl— |
| B.消耗1 mol还原剂,转移6 mol电子 |
| C.氧化剂与还原剂的物质的量之比为2:3 |
| D.反应后溶液的酸性明显增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在铜的催化作用下氨气与氟气反应,得到一种三角锥形分子M和一种铵盐N。下列有关说法错误的是
| A.该反应的化学方程式为4NH3+3F2→ NF3+3NH4F |
| B.M是极性分子,其还原性比NH3强 |
| C.M既是氧化产物,又是还原产物 |
| D.N中既含有离子键,又含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
NaClO2可用作造纸的漂白剂,它由H2O2+2ClO2+2NaOH=2NaClO2+2H2O+O2制得,下列说法正确的是
| A.H2O2是氧化剂,H2O2中的氧元素被还原 |
| B.每生成1 mol O2转移的电子的物质的量为4 mol |
| C.ClO2中的氯元素被氧化 |
| D.ClO2是氧化剂,H2O2是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某含铬[Cr2O72-] 废水用硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀,该沉淀干燥后得到n molFeO·FeyCrxO3。不考虑处理过程中的实际损耗,下列叙述错误的是
| A.消耗硫酸亚铁铵的物的质量为n(2-x)mol |
B.处理废水中Cr2O72- 的物质量为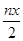 mol mol |
| C.反应中发生转移的电子数为3nx mol |
| D.在FeO·FeyCrxO3中3x=y |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com