
【题目】食盐是一种与人类生活最密切的物质之一。以食盐为原料可以制取金属钠、氯气、氢气、烧碱等宝贵的化学用品和化工原料。
(1)写出工业制备金属钠的化学方程式:________。
(2)电解________可制得烧碱、氢气和氯气,这称为________工业。写出该工业中的电极反应式及总反应式:阳极_________;阴极________;总反应式________。
(3)我国著名的化工专家侯德榜发明的“联合制碱”法也以食盐为基础原料,该方法为先向饱和食盐水中通入![]() ,再通入
,再通入![]() 气体,析出
气体,析出![]() 晶体,化学方程式为________;将析出的
晶体,化学方程式为________;将析出的![]() 晶体灼烧即得纯碱,化学方程式为___________。
晶体灼烧即得纯碱,化学方程式为___________。
【答案】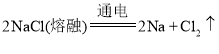 饱和食盐水 氯碱
饱和食盐水 氯碱 ![]()
![]()
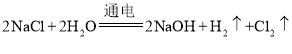
![]()
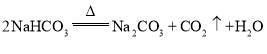
【解析】
(1)工业上用电解熔融NaCl制备金属钠;
(2)氯碱工业上电解饱和食盐水生成烧碱和氢气、氯气,据此分析解答;
(3)先向饱和食盐水中通入![]() ,再通入
,再通入![]() 气体,析出
气体,析出![]() 晶体,然后碳酸氢钠在加热的条件下生成碳酸钠,据此分析解答。
晶体,然后碳酸氢钠在加热的条件下生成碳酸钠,据此分析解答。
(1)工业上用电解熔融NaCl制备金属钠,化学方程式为:2NaCl(熔融)![]() 2Na+Cl2↑,故答案为:2NaCl(熔融)
2Na+Cl2↑,故答案为:2NaCl(熔融)![]() 2Na+Cl2↑;
2Na+Cl2↑;
(2)氯碱工业上用惰性电极电解饱和食盐水的方法制取烧碱和氢气、氯气,与电源正极相连的为阳极,与电源负极相连的为阴极,电解过程中,阳极上Cl-的放电能力强于OH-,氯离子失去电子,发生氧化反应,电极反应式为:2Cl--2e-═Cl2↑,阴极上水电离的氢离子得到电子发生还原反应生成氢气,电极反应式为:2H++2e-=H2↑,电解总反应为:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,故答案为:饱和食盐水;氯碱;2Cl--2e-═Cl2↑;2H++2e-=H2↑;2NaCl+2H2O
2NaOH+H2↑+Cl2↑,故答案为:饱和食盐水;氯碱;2Cl--2e-═Cl2↑;2H++2e-=H2↑;2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑;
2NaOH+H2↑+Cl2↑;
(3)由“侯氏制碱法”的基本原理可知:先向饱和食盐水中通入![]() ,再通入
,再通入![]() 气体,析出
气体,析出![]() 晶体,反应的化学方程式为:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl,碳酸氢钠在加热的条件下生成碳酸钠、水和二氧化碳,化学方程式为:2NaHCO3
晶体,反应的化学方程式为:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl,碳酸氢钠在加热的条件下生成碳酸钠、水和二氧化碳,化学方程式为:2NaHCO3 ![]() Na2CO3+CO2↑+H2O,故答案为:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl;2NaHCO3
Na2CO3+CO2↑+H2O,故答案为:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl;2NaHCO3 ![]() Na2CO3+CO2↑+H2O。
Na2CO3+CO2↑+H2O。


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】将2.3g Na和2.7g Al同时加入到足量的水中充分反应,将反应后的溶液稀释、定容为500mL。下列说法正确的是
A.整个反应过程中共转移电子0.4 mol
B.反应产生的气体在标准状况下的体积是1.12L
C.反应所得溶液与足量CO2反应的离子方程式:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
D.在稀释、定容操作中用到的全部玻璃仪有:烧杯、玻璃棒、500mL容量瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国成功发射的“嫦娥”卫星和“玉兔”月球车对探究月球结构和资源开发具有极为重要的战略意义。请回答下列问题:
(1)发射“嫦娥”卫星使用了大功率运载火箭,火箭推进器中装有还原剂肼![]() 和强氧化剂过氧化氢
和强氧化剂过氧化氢![]() ,其反应为
,其反应为 ,已知生成
,已知生成![]() 释放出
释放出![]() 热量。
热量。
①写出![]() 在催化剂作用下分解的化学方程式:_______。
在催化剂作用下分解的化学方程式:_______。
②用电子式表示![]() 的形成过程:_______。
的形成过程:_______。
③若该火箭推进器中![]() 有
有![]() 共价键发生断裂,释放出的热量为_______
共价键发生断裂,释放出的热量为_______![]() 。
。
(2)镍氢蓄电池具有能量密度大、电压高、可多次反复充放电等特性而被用于“玉兔”月球车上,![]() 溶液作电解液,其放电时,正极的电极反应式为
溶液作电解液,其放电时,正极的电极反应式为![]() ,负极的电极反应式为
,负极的电极反应式为 ,利用太阳能充电时负极的电极反应式为
,利用太阳能充电时负极的电极反应式为 。
。
①该镍氢蓄电池放电时的总反应方程式为_______。
②该电池利用太阳能充电时正极的电极反应式为_______。
③该电池工作时,![]() 向_______(填“正极”或“负极”)迁移。
向_______(填“正极”或“负极”)迁移。
④假设电池工作时有![]() 个电子从负极流向正极,则消耗的H2在标准状况下的体积为_______L。
个电子从负极流向正极,则消耗的H2在标准状况下的体积为_______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:①101kPa时,C(s)+![]() O2(g)=CO(g) △H1=-110.5kJ/mol
O2(g)=CO(g) △H1=-110.5kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(1) △H2=-57.3kJ/mol
下列结论正确的是( )
A.①是碳的燃烧热的热化学方程式
B.碳的燃烧热大于110.5kJ/mol
C.浓硫酸与稀NaOH溶液反应的中和热为57.3kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同一短周期元素甲、乙、丙、丁原子序数依次增大。常温下,含甲的化合物r浓度为0.1mol·L-1时溶液pH=13。同周期元素简单离子中,乙离子的半径最小。p和q分别是元素丙和丁的单质,其中p为浅黄色固体。上述物质的转化关系如图所示(产物水已略去)。下列说法不正确的是
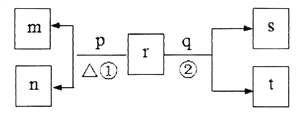
A. 原子半径的大小关系:甲>乙>丙>丁
B. 反应②的离子方程式为:C12+H2O![]() H++C1-+HC1O
H++C1-+HC1O
C. m、n的阴离子在酸性条件下不能大量共存
D. 甲、乙、丁的最高价氧化物对应水化物两两之间均可以发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶滚中可能含有Na+、NH4+、Ba2+、Cu2+、SO42﹣、SO32﹣、Cl﹣、Br﹣、CO32﹣中的若干种.为检验其中含有的离子,进行如下实验:
①取10mL溶液,加入足量氯水,无气体产生,再加入CCl4溶液分层,下层为橙红色;
②分液后,将①中上层溶液加入足量BaCl2和HCl溶液,产生白色沉淀2.33g;
③另取10mL原溶液,加入过量的浓氢氧化钠溶液并加热,收集到标准状况下448mL气体.下列关于原溶液的说法正确的是
A. 肯定存在NH4+、Cl﹣、Br﹣
B. SO42﹣、SO32﹣至少含有一种
C. 是否存在Na+需要通过焰色反应来确定
D. 肯定不存在Ba2+、Cu2+、SO32﹣、CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置探究碳酸和苯酚的酸性强弱,下列叙述不正确的是(部分夹持仪器省略) ( )
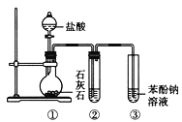
A.②中试剂为饱和Na2CO3溶液
B.打开分液漏斗旋塞,①中产生无色气泡,③中出现白色浑浊
C.苯酚有弱酸性,是由于苯基影响了与其相连的羟基的活性
D.③中反应:2![]() +CO2+H2O→2
+CO2+H2O→2![]() +Na2CO3
+Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液滴加到己二酸![]() 溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是
溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是

A.曲线M表示pH与 的变化关系
的变化关系
B.![]() 的数量级为
的数量级为![]()
C.NaHX溶液中![]()
D.当混合溶液呈中性时,![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com